人造细胞(Artificial cell)或最小细胞(Minimal cell)是模拟生物细胞的一种或多种功能的工程化颗粒。 该术语不是指特定的物理实体,而是指可以用合成实体替换或补充生物细胞的某些功能或结构的想法。 通常,人造细胞是包围生物活性物质的生物或聚合物膜。 因此,纳米颗粒,脂质体,聚合物囊泡,微胶囊和许多其他颗粒具有作为人造细胞的资格。 微囊化允许膜内的代谢,小分子的交换和防止大物质通过它。 包封的主要优点包括改善体内模拟,增加货物的溶解度和降低免疫反应。 值得注意的是,人工细胞在血液灌流方面已在临床上取得了成功。
在合成生物学领域,“活的”人造细胞被定义为完全合成的细胞,可以捕获能量,维持离子梯度,含有大分子以及储存信息并具有变异的能力。 这种细胞在技术上尚不可行,但已经创造了人工细胞的变体,其中将完全合成的基因组引入基因组清空的宿主细胞中。 尽管不是完全人工的,因为保留了细胞质组分以及来自宿主细胞的膜,但是工程细胞在合成基因组的控制下并且能够复制。
历史
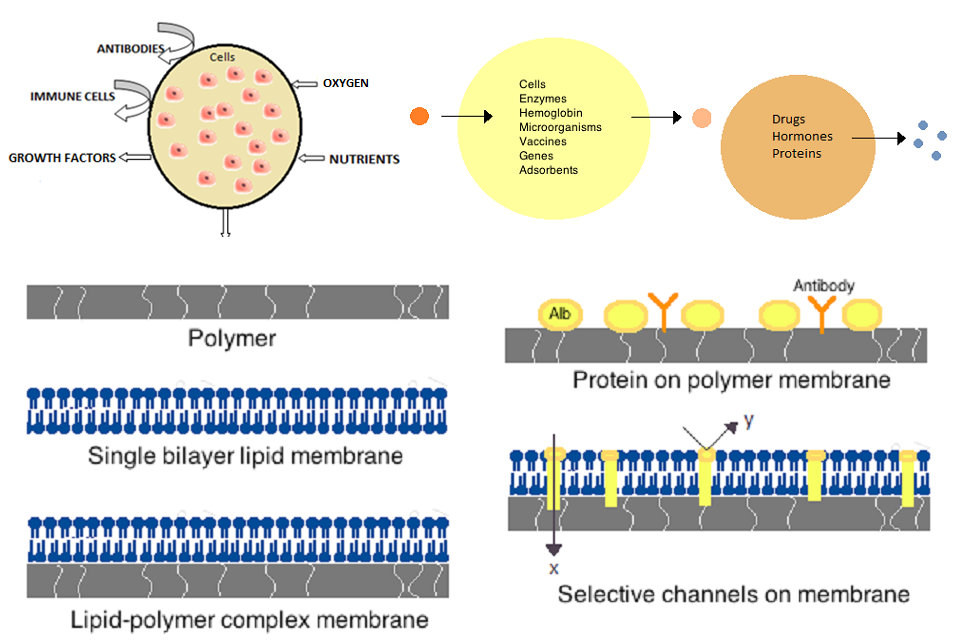
第一个人工细胞是由20世纪60年代麦吉尔大学的Thomas Chang开发的。 这些细胞由尼龙,火棉胶或交联蛋白的超薄膜组成,其半透性使小分子能够扩散进出细胞。 这些细胞是微米级的,含有细胞,酶,血红蛋白,磁性材料,吸附剂和蛋白质。
后来的人造细胞范围从百微米到纳米,可以携带微生物,疫苗,基因,药物,激素和多肽。 人工细胞的第一次临床应用是通过包封活性炭进行血液灌流。
在20世纪70年代,研究人员能够将酶,蛋白质和激素引入可生物降解的微胶囊中,后来导致临床用于Lesch-Nyhan综合征等疾病。 尽管Chang的最初研究主要集中在人造红细胞上,但仅在20世纪90年代中期才开发出可生物降解的人造红细胞。 生物细胞包封中的人工细胞于1994年首次在临床中用于糖尿病患者的治疗,此后其他类型的细胞如肝细胞,成体干细胞和基因工程细胞已经被包封并且正在研究用于组织再生。 。
2011年12月29日,哈佛大学的化学家们报告了人造细胞膜的产生。
到2014年,已经生产出具有细胞壁和合成DNA的自我复制的合成细菌细胞。 当年1月,研究人员研制出一种人工真核细胞,能够通过工作细胞器进行多种化学反应。
2018年9月,加利福尼亚大学的研究人员开发出可以杀死细菌的人造细胞。 这些细胞是自下而上的 – 像乐高积木一样 – 来破坏细菌。
物料
用于人造细胞的膜由简单聚合物,交联蛋白质,脂质膜或聚合物 – 脂质复合物制成。 此外,可以改造膜以呈递表面蛋白质,例如白蛋白,抗原,Na / K-ATP酶载体,或诸如离子通道的孔。 用于生产膜的常用材料包括水凝胶聚合物,例如藻酸盐,纤维素和热塑性聚合物,例如甲基丙烯酸羟乙酯 – 甲基丙烯酸甲酯(HEMA-MMA),聚丙烯腈 – 聚氯乙烯(PAN-PVC),以及上述的变化形式 – 提及。 使用的材料决定了细胞膜的渗透性,对于聚合物而言,其取决于截留的分子量(MWCO)。 MWCO是可以自由通过孔隙的分子的最大分子量,并且对于确定营养物,废物和其他关键分子的充分扩散是重要的。 亲水性聚合物具有生物相容性的潜力,并且可以制成各种形式,包括聚合物胶束,溶胶 – 凝胶混合物,物理共混物和交联颗粒和纳米颗粒。 特别感兴趣的是刺激响应性聚合物,其响应pH或温度变化以用于靶向递送。 这些聚合物可以通过肉眼注射以液体形式给药,并且由于pH或温度的不同而原位固化或凝胶化。 纳米颗粒和脂质体制剂也常规用于材料包封和递送。 脂质体的一个主要优点是它们融合细胞和细胞器膜的能力。
制备
已经开发了许多用于人造细胞制备和包封的变体。 通常,合成诸如纳米颗粒,聚合物囊泡或脂质体的囊泡。 通常通过使用高压设备如高压均化器或微流化器制备乳液。 硝酸纤维素的两种微囊化方法也在下面描述。
高压均质化
在高压均化器中,油/液悬浮液中的两种液体在非常高的压力下被迫通过小孔。 这个过程将产品分开,并允许产生小至1纳米的极细颗粒。
微流
该技术使用获得专利的微流化器来获得更大量的均匀悬浮液,其可以产生比均化器更小的颗粒。 首先使用均化器产生粗悬浮液,然后在高压下将其泵入微流化器中。 然后将流分成两股流,它们将在相互作用室中以非常高的速度反应,直到获得所需的粒度。 该技术允许大规模生产磷脂脂质体和随后的材料纳米包封。
掉落法
在该方法中,将细胞溶液逐滴加入到硝酸纤维素的火棉胶溶液中。 当液滴穿过火棉胶时,由于火棉胶的界面聚合特性,它被涂有膜。 随后细胞沉降到石蜡中,膜固定,最后悬浮在盐水溶液中。 滴法用于产生大的人工细胞,其包封生物细胞,干细胞和基因工程干细胞。
乳液法
乳液方法的不同之处在于待包封的材料通常较小并且放置在反应室的底部,其中将火棉胶加到顶部并离心,或以其他方式扰乱以产生乳液。 然后将包封的材料分散并悬浮在盐水溶液中。
临床意义
药物释放和交付
用于药物递送的人造细胞与其他人造细胞不同,因为它们的内容物旨在扩散出膜,或被宿主靶细胞吞噬和消化。 通常使用的是亚微米,脂质膜人工细胞,其可以称为纳米胶囊,纳米颗粒,聚合物囊泡或该术语的其他变体。
酶疗法
正在积极研究酶疗法用于遗传代谢疾病,其中酶过度表达,表达不足,有缺陷或根本不存在。 在表达不足或表达缺陷酶的情况下,将活性形式的酶引入体内以补偿缺乏。 另一方面,可以通过引入竞争性非功能性酶来抵消酶促过表达; 即,将底物代谢成非活性产物的酶。 当置于人工细胞内时,与游离酶相比,酶可以在更长的时间内发挥其功能,并且可以通过聚合物缀合进一步优化。
在人工细胞包封下研究的第一种酶是天冬酰胺酶,用于治疗小鼠的淋巴肉瘤。 该治疗延迟了肿瘤的发作和生长。 这些初步研究结果进一步研究了人工细胞在酪氨酸依赖性黑素瘤中的酶递送的应用。 这些肿瘤对酪氨酸的依赖性高于正常细胞的生长,研究表明,降低小鼠体内酪氨酸水平可抑制黑色素瘤的生长。 使用人工细胞递送酪氨酸酶; 和消化酪氨酸的酶,可以提供更好的酶稳定性,并且在除去酪氨酸方面显示出有效,而没有与饮食中酪氨酸褪色相关的严重副作用。
人工细胞酶疗法对于某些癌症中的前药例如异环磷酰胺的活化也是有意义的。 包封将该前药转化为活性药物的细胞色素p450酶的人工细胞可以定制为在胰腺癌中积累或将人工细胞植入靠近肿瘤部位。 这里,活化的异环磷酰胺的局部浓度将远高于身体其他部分,从而防止全身毒性。 该治疗在动物中是成功的,并且在I / II期临床试验中显示晚期胰腺癌患者的中位生存期加倍,并且一年存活率增加三倍。
基因治疗
在遗传疾病的治疗中,基因治疗旨在插入,改变或去除患病个体细胞内的基因。 该技术在很大程度上依赖于病毒载体,这引起了对临床试验中导致人类死亡和白血病发展的插入诱变和全身免疫应答的担忧。 通过使用裸DNA或质粒DNA作为其自身的递送系统来规避对载体的需要也遇到诸如系统性给予的低转导效率和差的组织靶向的问题。
已经提出人工细胞作为非病毒载体,通过该载体将包被并植入遗传修饰的非自体细胞以在体内递送重组蛋白。 已经证明这种类型的免疫分离通过递送含有小鼠生长激素的人工细胞在小鼠中有效,所述小鼠生长激素拯救了突变小鼠中的生长迟缓。 一些策略已经推进到用于治疗胰腺癌,侧索硬化和疼痛控制的人体临床试验。
血液灌流
人工细胞的第一次临床应用是通过包封活性炭进行血液灌流。 活性炭具有吸附许多大分子的能力,并且长期以来已知其能够在意外中毒或过量使用时从血液中除去有毒物质。 然而,通过直接给予木炭的灌注是有毒的,因为它导致血细胞的栓塞和损伤,然后通过血小板去除。 人造细胞允许毒素扩散到细胞中,同时将危险的货物保持在其超薄膜内。
已经提出人造细胞血液灌流作为比血液透析更低成本和更有效的解毒选择,其中血液过滤仅通过物理膜的尺寸分离进行。 在血液灌流中,通过在患者血液灌注的任一端使用两个筛网,将数千个吸附人造细胞保留在小容器内。 当血液循环时,毒素或药物扩散到细胞中并被吸收材料保留。 人造细胞的膜比透析中使用的膜薄得多,它们的小尺寸意味着它们具有高的膜表面积。 这意味着一部分细胞的理论传质可以比整个人造肾机高一百倍。 该装置已被确立为针对意外或自杀中毒治疗的患者的常规临床方法,但也通过实施这些器官的部分功能而被引入作为肝衰竭和肾衰竭的治疗。 还提出了人工细胞血液灌流用于免疫吸附,通过在人造细胞的表面上附着免疫吸附材料如白蛋白,可以从体内除去抗体。 该原理已用于从血浆中去除血型用于骨髓移植和通过单克隆抗体治疗高胆固醇血症以去除低密度脂蛋白。 血液灌流在血液透析制造工业较弱的国家尤其有用,因为那里的设备往往更便宜并且用于肾衰竭患者。
封装细胞
制备人造细胞的最常用方法是通过细胞包封。 通常通过从液体细胞悬浮液产生受控尺寸的液滴来实现包封的细胞,然后将其快速固化或凝胶化以提供增加的稳定性。 可以通过改变温度或通过材料交联来实现稳定化。 细胞看到的微环境在封装时会发生变化。 它通常从单层到聚合物膜内聚合物支架中的悬浮液。 该技术的缺点是包封细胞会降低其活力和增殖和分化能力。 此外,在微胶囊内一段时间后,细胞形成簇,其抑制氧和代谢废物的交换,导致细胞凋亡和坏死,从而限制细胞的功效并激活宿主的免疫系统。 人工细胞已经成功移植了许多细胞,包括用于治疗糖尿病的朗格汉斯胰岛,甲状旁腺细胞和肾上腺皮质细胞。
包裹的肝细胞
器官捐献者的短缺使人工细胞成为肝衰竭替代疗法的关键参与者。 人工细胞在肝细胞移植中的应用已证明在动物肝病和生物人工肝装置模型中提供肝功能的可行性和有效性。 研究阻止了肝细胞附着于微载体表面并进化成肝细胞的实验,所述肝细胞被包裹在由聚赖氨酸外皮覆盖的藻酸盐微滴中的三维基质中。 该递送方法的关键优点是在治疗期间规避免疫抑制疗法。 已经提出将肝细胞包封用于生物人工肝脏。 该装置由嵌入有分离的肝细胞的圆柱形腔室组成,患者血浆通过该腔室在一种血液灌流中体外循环。 因为微胶囊具有高表面积与体积比,所以它们为基质扩散提供了大的表面并且可以容纳大量的肝细胞。 对诱导的肝衰竭小鼠的治疗显示存活率显着增加。 人工肝系统仍处于早期发展阶段,但对于等待器官移植或患者自身肝脏再生以恢复正常功能的患者显示出潜力。 到目前为止,在终末期肝病中使用人工肝系统和肝细胞移植的临床试验已经显示出健康标志物的改善,但尚未提高生存率。 移植后人工肝细胞的短寿命和聚集是遇到的主要障碍。 与干细胞共同包裹的肝细胞在培养中显示出更大的活力,并且在植入和单独植入人工干细胞后也显示出肝再生。 因此,在使用干细胞用于再生医学中的封装中出现了这种兴趣。
包裹的细菌细胞
已经提出口服摄取活细菌细胞集落,并且目前正在用于调节肠道菌群,预防腹泻疾病,治疗幽门螺杆菌感染,特应性炎症,乳糖不耐受和免疫调节等。 拟议的行动机制尚未完全理解,但据信有两个主要影响。 首先是营养效应,其中细菌与产生毒素的细菌竞争。 第二是卫生效应,它刺激对殖民化的抵抗并刺激免疫反应。 细菌培养物的口服递送通常是一个问题,因为它们是免疫系统的目标并且经常在口服时被破坏。 人造细胞通过向体内提供模拟和选择性或长期释放来帮助解决这些问题,从而增加细菌到达胃肠系统的可行性。 此外,可以设计活细菌细胞包封以允许包括肽的小分子扩散到体内用于治疗目的。 已经证明成功用于细菌递送的膜包括醋酸纤维素和藻酸盐的变体。 从细菌细胞的包封中获得的其他用途包括针对来自结核分枝杆菌的攻击的保护和来自免疫系统的Ig分泌细胞的上调。 该技术受到全身感染,不良代谢活动和基因转移风险的限制。 然而,更大的挑战仍然是向感兴趣的部位递送足够的活细菌。
人造血细胞
氧载体
纳米氧载体被用作一种红细胞替代品,尽管它们缺乏红细胞的其他成分。 它们由合成的聚合物囊泡或围绕纯化的动物,人或重组血红蛋白的人造膜组成。 总体而言,血红蛋白的输送仍然是一个挑战,因为它在没有任何改变的情况下交付时具有高毒性。 在一些临床试验中,已观察到第一代血红蛋白血液替代品的血管加压作用。
红细胞
在20世纪80年代的艾滋病恐慌之后,出现了人造细胞用于血液的研究兴趣。 除了绕过疾病传播的可能性之外,还需要人造红细胞,因为它们消除了与同种异体输血相关的缺点,例如血型,免疫反应和42天的短暂储存期。 血红蛋白替代物可以在室温下储存,而不是在冷藏下储存超过一年。 已经尝试开发一种完整的工作红细胞,其不仅含有碳载体,还含有与细胞有关的酶。 第一次尝试是在1957年通过超薄聚合物膜替换红细胞膜,然后通过脂质膜包封,最近是可生物降解的聚合物膜。 包括脂质和相关蛋白的生物红细胞膜也可用于包封纳米颗粒并通过绕过巨噬细胞摄取和全身清除来增加体内停留时间。
脑白质的聚合物囊泡
白细胞 – 聚合物囊泡是一种聚合物囊泡,其被设计成具有白细胞的粘附特性。 聚合物囊泡是由双层片组成的囊泡,其可以包封许多活性分子,例如药物或酶。 通过将白细胞的粘附性质添加到它们的膜中,可以使它们在快速流动的循环系统内减慢或沿着上皮壁滚动。
合成细胞
最小的细胞
德国病理学家Rudolf Virchow提出这样的观点,即生命不仅来自细胞,而且每个细胞来自另一个细胞; “Omnis cellula e cellula”。 到目前为止,大多数创建人工细胞的尝试只创建了一个可以模仿细胞某些任务的包。 无细胞转录和翻译反应的进展允许许多基因的表达,但这些努力远不能产生完全可操作的细胞。
未来是创造一个原始细胞,或一个对生命有最低要求的细胞。 来自J. Craig Venter研究所的成员使用自上而下的计算方法将生物体中的基因敲除到最小的基因组。 2010年,该团队成功地利用合成产生的DNA创造了一种复制的Mycoplasma mycoides菌株(Mycoplasma laboratorium),这种DNA被认为是插入基因组空菌中的生命的最低要求。 希望自上而下生物合成的过程能够插入新基因,这些新基因可以执行有利可图的功能,例如产生氢气用于燃料或捕获大气中过量的二氧化碳。 无数的调节,代谢和信号网络尚未完全表征。 这些自上而下的方法对于理解基本分子调节具有局限性,因为宿主生物具有复杂且不完全确定的分子组成。
自下而上的构建人造细胞的方法将涉及从无生命材料中重新创建原始细胞。 建议用能够使用合成遗传信息自我复制的DNA产生磷脂双层囊泡。 这种人工细胞的三个主要元素是脂质膜的形成,通过模板过程的DNA和RNA复制以及用于跨膜的主动转运的化学能的收获。 这个拟议的原始细胞预见和遇到的主要障碍是创造一种最小的合成DNA,它可以保存生命中所有足够的信息,以及细胞发育中不可或缺的非遗传成分的繁殖,如分子自组织。 然而,希望这种自下而上的方法能够洞察组织在细胞水平上的基本问题和生物生命的起源。 到目前为止,还没有使用生命分子合成能够自我繁殖的完全人工细胞,尽管目前各种群体正在努力实现这一目标,但这一目标仍处于遥远的未来。
提出用于产生原始细胞的另一种方法更接近于被认为在进化过程中存在的被称为原始汤的条件。 可以将各种RNA聚合物包封在囊泡中,并且在如此小的边界条件下,将测试化学反应。
埃克森美孚(ExxonMobil)等大型公司已经对生物学进行了大量投资,后者与Synthetic Genomics Inc合作; Craig Venter自己的生物合成公司在开发藻类燃料方面。
电子人造细胞
电子人工细胞的概念已经在John McCaskill从2004年至2015年协调的一系列3个欧盟项目中得到了扩展。
欧盟委员会赞助了2004 – 2008年“可编程人工细胞进化”(PACE)计划的开发,其目标是为创建“微观自组织,自我复制和可进化的自主实体”奠定基础。有机和无机物质,可以进行遗传编程,以执行特定功能,“最终融入信息系统。 PACE项目开发了第一台Omega Machine,这是一种用于人工细胞的微流体生命支持系统,可以补充化学缺失的功能(最初由Norman Packard,Steen Rasmussen,Mark Beadau和John McCaskill提出)。 最终目标是在复杂的微型可编程环境中实现可演化的混合单元。 然后可逐步移除Omega机器的功能,对人工细胞化学构成一系列可解决的进化挑战。 该项目实现了化学整合,达到人工细胞(遗传子系统,遏制系统和代谢系统)三个核心功能对的水平,并产生了新的空间分辨可编程微流体环境,用于整合遏制和遗传扩增。 “可编程人工细胞进化”(PACE)该项目促成了欧洲生命技术中心的建立,现在正在继续进行类似的研究。
在这项研究之后,2007年,约翰麦卡斯基尔提议将注意力集中在电子补充的人造细胞上,称为电子化学细胞。 关键的想法是使用大规模并行电极阵列耦合到局部专用电子电路,在二维薄膜中,以补充新兴的化学细胞功能。 定义电极切换和感测电路的局部电子信息可以用作电子基因组,补充新兴协议中的分子序列信息。 一项研究提案在欧洲委员会取得了成功,一个国际科学家团队与PACE联盟部分重叠,开始了关于电子化学细胞项目的2008 – 2012年工作。 该项目除其他外表明,电子控制的特定序列的局部转运可以用作未来人工细胞遗传增殖的人工空间控制系统,并且可以通过适当涂覆的电极阵列递送代谢的核心过程。
除了掌握微尺度电化学和电动力学的最初困难之外,该方法的主要限制是电子系统作为刚性的非自主宏观硬件互连。 2011年,麦卡斯基尔提出要颠倒电子和化学的几何形状:不是将化学品放在有源电子介质中,而是将微观自主电子设备放置在化学介质中。 他组织了一个项目,以100微米的规模处理第三代电子人工细胞,可以从两个半电池“标签”自组装以封闭内部化学空间,并借助于由介质驱动的有源电子设备起作用这些细胞可以复制它们的电子和化学成分,并且能够在其特殊的预合成微观构建块提供的限制内进化。 2012年9月,该项目微尺度化学反应电子代理商开始工作。
道德和争议
Protocell研究引发了争议和反对意见,包括对“人造生命”模糊定义的批评。 创建一个基本的生活单元是最迫切的道德问题,尽管对原始细胞最普遍的担忧是它们通过不受控制的复制对人类健康和环境的潜在威胁。