Хромофор является частью молекулы, ответственной за ее цвет. Цвет, который видят наши глаза, — это тот, который не поглощается в определенном спектре длин волн видимого света. Хромофор — это область в молекуле, где разность энергий между двумя отдельными молекулярными орбиталями попадает в диапазон видимого спектра. Видимый свет, попадающий в хромофор, может, таким образом, поглощаться путем возбуждения электрона из его основного состояния в возбужденное состояние.
В биологических молекулах, которые служат для захвата или обнаружения световой энергии, хромофор представляет собой фрагмент, который вызывает конформационное изменение молекулы при попадании света.
Конъюгированные хромофоры системы pi-bond
В сопряженных хромофорах электроны прыгают между уровнями энергии, которые являются расширенными pi-орбиталями, создаваемыми рядом чередующихся одинарных и двойных связей, часто в ароматических системах. Обычными примерами являются сетчатка (используется в глазу для обнаружения света), различные пищевые красители, тканевые красители (азосоединения), индикаторы рН, ликопин, β-каротин и антоцианы. Различные факторы в структуре хромофора вступают в определение в какой области длины волны в спектре, который поглотит хромофор. Удлинение или расширение конъюгированной системы с более ненасыщенными (множественными) связями в молекуле будет иметь тенденцию смещать поглощение на более длинные волны. Правила Вудворда-Физера могут быть использованы для аппроксимации максимальной длины волны поглощения ультрафиолетового излучения в органических соединениях с сопряженными системами пи-связи.
Некоторые из них представляют собой металлокомплексные хромофоры, которые содержат металл в координационном комплексе с лигандами. Примерами являются хлорофилл, который используют растения для фотосинтеза и гемоглобина, переносчик кислорода в крови позвоночных животных. В этих двух примерах металл скомпенсирован в центре кольца тетрапиррольного макроцикла: металл представляет собой железо в группе гема (железо в порфириновом кольце) гемоглобина или магний, образованный в кольце хлоринового типа в случае хлорофилла , Высококонъюгированная pi-связующая система кольца макроцикла поглощает видимый свет. Характер центрального металла также может влиять на спектр поглощения комплекса металл-макроцикл или такие свойства, как время жизни возбужденного состояния. Тетрапирольный фрагмент в органических соединениях, который не является макроциклическим, но все еще имеет конъюгированную систему пи-связи, по-прежнему действует как хромофор. Примеры таких соединений включают билирубин и уробилин, которые имеют желтый цвет.
Auxochrome
Ауксхохром представляет собой функциональную группу атомов, присоединенную к хромофору, которая модифицирует способность хромофора поглощать свет, изменяя длину волны или интенсивность поглощения.
Галохромизм в хромофорах
Галохромизм возникает, когда вещество меняет цвет при изменении рН. Это свойство индикаторов рН, молекулярная структура которых изменяется при определенных изменениях окружающего рН. Это изменение структуры влияет на хромофор в молекуле индикатора рН. Например, фенолфталеин является индикатором рН, структура которого изменяется с изменением рН, как показано в следующей таблице:
| Structure | 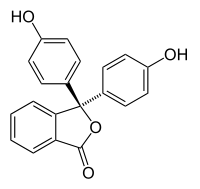 |
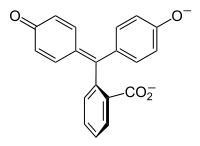 |
|---|---|---|
| pH | 0-8.2 | 8.2-12 |
| Conditions | acidic or near-neutral | basic |
| Color name | colorless | pink to fuchsia |
| Color |
В диапазоне рН около 0-8 молекула имеет три ароматических кольца, все связанные с тетраэдрическим sp3-гибридизованным атомом углерода в середине, что не связывает π-связь в ароматических кольцах. Из-за их ограниченной степени ароматические кольца поглощают свет только в ультрафиолетовой области, и поэтому соединение оказывается бесцветным в диапазоне рН 0-8. Однако по мере того, как рН увеличивается выше 8,2, этот центральный углерод становится частью двойной связи, которая становится sp2 гибридизированной и оставляя p-орбиталь перекрываться с π-связью в кольцах. Это делает три кольца сопряженными вместе, чтобы сформировать расширенный хромофор, поглощающий более длинный видимый свет длины волны, чтобы показать цвет фуксии. При значениях рН, превышающих 0-12, другие изменения молекулярной структуры приводят к другим изменениям цвета; см. «Фенолфталеин».