Искусственная ячейка или минимальная ячейка представляет собой сконструированную частицу, которая имитирует одну или многие функции биологической клетки. Этот термин относится не к конкретному физическому объекту, а скорее к идее о том, что некоторые функции или структуры биологических клеток могут быть заменены или дополнены синтетическим объектом. Часто искусственными клетками являются биологические или полимерные мембраны, которые включают биологически активные вещества. Как таковые, наночастицы, липосомы, полимеры, микрокапсулы и ряд других частиц квалифицируются как искусственные клетки. Микроинкапсуляция позволяет метаболизм внутри мембраны, обмен небольшими молекулами и предотвращение прохождения через нее крупных веществ. Основные преимущества инкапсуляции включают улучшение мимикрии в организме, повышенную растворимость груза и снижение иммунных реакций. Примечательно, что искусственные клетки были клинически успешными в гемоперфузии.
В области синтетической биологии «живая» искусственная клетка была определена как полностью синтетически сделанная клетка, которая может захватывать энергию, поддерживать градиенты ионов, содержать макромолекулы, а также хранить информацию и иметь возможность мутировать. Такая клетка пока технически не осуществима, но была создана вариация искусственной клетки, в которую был введен полностью синтетический геном в геномно опорожненные клетки-хозяева. Хотя они и не являются полностью искусственными, поскольку цитоплазматические компоненты, а также мембрана из клетки-хозяина сохранены, сконструированная клетка находится под контролем синтетического генома и способна реплицироваться.
история
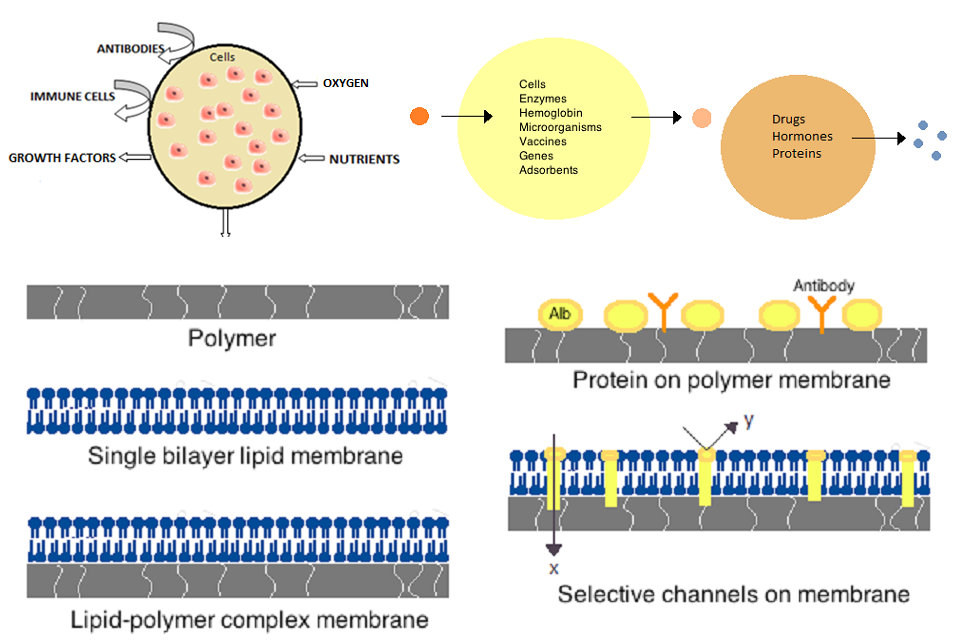
Первые искусственные клетки были разработаны Томасом Чангом в Университете Макгилла в 1960-х годах. Эти клетки состояли из ультратонких мембран нейлона, коллодиона или сшитого белка, полупроницаемые свойства которых позволили диффузию малых молекул в клетку и из нее. Эти клетки были размером в микроны и содержали клетки, ферменты, гемоглобин, магнитные материалы, адсорбенты и белки.
Позднее искусственные клетки варьировались от 100 мкм до нанометровых размеров и могут переносить микроорганизмы, вакцины, гены, лекарства, гормоны и пептиды. Первое клиническое использование искусственных клеток было в гемоперфузии путем инкапсуляции активированного угля.
В 1970-х годах исследователи смогли ввести ферменты, белки и гормоны в биоразлагаемые микрокапсулы, что позднее привело к клиническому применению при таких заболеваниях, как синдром Леша-Нихана. Хотя первоначальные исследования Чанга были сосредоточены на искусственных эритроцитах, только в середине 1990-х годов были разработаны биоразлагаемые искусственные эритроциты. Искусственные клетки в инкапсуляции биологических клеток были впервые использованы в клинике в 1994 году для лечения у пациента с диабетом, и с тех пор другие типы клеток, такие как гепатоциты, взрослые стволовые клетки и генно-инженерные клетки, были инкапсулированы и изучены для использования в регенерации тканей ,
29 декабря 2011 года химики Гарвардского университета сообщили о создании искусственной клеточной мембраны.
К 2014 году были получены самовоспроизводящиеся, синтетические бактериальные клетки с клеточными стенками и синтетической ДНК. В январе того же года исследователи создали искусственную эукариотическую клетку, способную проводить многочисленные химические реакции через рабочие органеллы.
В сентябре 2018 года исследователи из Калифорнийского университета разработали искусственные клетки, которые могут убивать бактерии. Клетки были спроектированы из восходящих блоков Lego — для уничтожения бактерий.
материалы
Мембраны для искусственных клеток изготавливают из простых полимеров, сшитых белков, липидных мембран или полимер-липидных комплексов. Кроме того, мембраны могут быть сконструированы таким образом, чтобы представлять поверхностные белки, такие как альбумин, антигены, носители Na / K-АТФазы или поры, такие как ионные каналы. Обычно используемые материалы для производства мембран включают гидрогелевые полимеры, такие как альгинат, целлюлоза и термопластичные полимеры, такие как гидроксиэтилметакрилат-метилметакрилат (HEMA-MMA), полиакрилонитрил-поливинилхлорид (PAN-PVC), а также вариации вышеописанных материалов, упоминается. Используемый материал определяет проницаемость клеточной мембраны, которая для полимера зависит от отсечки молекулярной массы (MWCO). MWCO — это максимальная молекулярная масса молекулы, которая может свободно проходить через поры и имеет важное значение для определения адекватной диффузии питательных веществ, отходов и других критических молекул. Гидрофильные полимеры могут быть биосовместимыми и могут быть изготовлены в различные формы, которые включают полимерные мицеллы, золь-гель-смеси, физические смеси и сшитые частицы и наночастицы. Особый интерес представляют реагирующие на стимулы полимеры, которые реагируют на изменения рН или температуры для использования при целенаправленной доставке. Эти полимеры можно вводить в жидкой форме с помощью макроскопической инъекции и затвердевать или гель in situ из-за разницы в рН или температуре. Наночастицы и липосомные препараты также обычно используются для капсулирования и доставки материала. Основным преимуществом липосом является их способность сливаться с мембранами клеток и органелл.
подготовка
Разработаны многие варианты подготовки и инкапсуляции искусственных клеток. Как правило, синтезируются везикулы, такие как наночастица, полимерсома или липосома. Эмульсию обычно проводят с использованием оборудования высокого давления, такого как гомогенизатор высокого давления или микрофлюидизатор. Ниже также описаны два способа микроинкапсулирования нитроцеллюлозы.
Гомогенизация высокого давления
В гомогенизаторе высокого давления две жидкости в масляной / жидкой суспензии вытесняются через небольшое отверстие под очень высоким давлением. Этот процесс делит продукты и позволяет создавать чрезвычайно мелкие частицы размером до 1 нм.
микрофлюидизацией
Этот метод использует запатентованный Microfluidizer для получения большего количества гомогенных суспензий, которые могут создавать меньшие частицы, чем гомогенизаторы. Гомогенизатор сначала используют для создания грубой суспензии, которая затем закачивается в микрофлюидизатор под высоким давлением. Затем поток разделяют на два потока, которые будут реагировать при очень высоких скоростях в камере взаимодействия до тех пор, пока не будет получен нужный размер частиц. Этот метод позволяет широкомасштабное производство фосфолипидных липосом и последующих нанонакапсулментов материала.
Метод падения
В этом способе клеточный раствор вводят по каплям в раствор коллодия целлюлозного нитрата. Когда капля проходит через коллодион, она покрыта мембраной благодаря свойствам межфазной полимеризации коллодия. Затем клетка оседает в парафин, где мембрана набирается и, наконец, суспендирует солевой раствор. Метод падения используется для создания больших искусственных клеток, которые инкапсулируют биологические клетки, стволовые клетки и генно-инженерные стволовые клетки.
Метод эмульсии
Способ эмульсии отличается тем, что материал, который должен быть инкапсулирован, обычно меньше и помещается в дно реакционной камеры, где коллодия добавляется сверху и центрифугируется или иным образом нарушается, чтобы создать эмульсию. Затем инкапсулированный материал диспергируют и суспендируют в физиологическом растворе.
Клиническая значимость
Выпуск и доставка лекарств
Искусственные клетки, используемые для доставки лекарств, отличаются от других искусственных клеток, так как их содержимое предназначено для диффузии из мембраны или поглощается и переваривается клеткой-мишенью-хозяином. Часто используются субмикронные, липидные мембранные искусственные клетки, которые можно назвать нанокапсулами, наночастицами, полимерсомами или другими вариациями термина.
Энзимная терапия
Ферментная терапия активно изучается для генетических метаболических заболеваний, где фермент чрезмерно выражен, недостаточно выражен, дефектен или вообще отсутствует. В случае недовыражения или экспрессии дефектного фермента активная форма фермента вводится в организм для компенсации дефицита. С другой стороны, ферментативную избыточную экспрессию можно противодействовать введением конкурирующего нефункционального фермента; то есть фермент, который метаболизирует субстрат в неактивные продукты. Когда они помещаются в искусственную клетку, ферменты могут выполнять свою функцию в течение гораздо более длительного периода времени по сравнению с свободными ферментами и могут быть дополнительно оптимизированы путем конъюгации полимера.
Первым ферментом, изучаемым при инкапсулировании искусственных клеток, была аспарагиназа для лечения лимфосаркомы у мышей. Это лечение задерживало начало и рост опухоли. Эти первоначальные данные привели к дальнейшим исследованиям в области использования искусственных клеток для доставки ферментов в тирозинзависимые меланомы. Эти опухоли имеют более высокую зависимость от тирозина, чем нормальные клетки для роста, и исследования показали, что снижение системных уровней тирозина у мышей может препятствовать росту меланом. Использование искусственных клеток при доставке тирозиназы; и фермент, который переваривает тирозин, позволяет улучшить ферментную стабильность и проявляется в эффективности удаления тирозина без серьезных побочных эффектов, связанных с развращением тирозина в рационе.
Искусственная клеточная ферментативная терапия также представляет интерес для активации пролекарств, таких как ифосфамид, при некоторых раковых заболеваниях. Искусственные клетки, инкапсулирующие фермент цитохрома р450, который превращает это пролекарство в активное лекарственное средство, могут быть адаптированы для накопления в карциноме поджелудочной железы или имплантации искусственных клеток, близких к опухолевому участку. Здесь локальная концентрация активированного ифосфамида будет намного выше, чем в остальной части тела, тем самым предотвращая системную токсичность. Лечение было успешным у животных и показало удвоение медианных выживаемостей среди пациентов с раком поджелудочной железы поздней стадии в клинических испытаниях фазы I / II и утроение в течение одного года выживаемости.
Генная терапия
При лечении генетических заболеваний генная терапия направлена на вставку, изменение или удаление генов в клетках пораженного человека. Технология в значительной степени зависит от вирусных векторов, что вызывает озабоченность по поводу инсерционного мутагенеза и системного иммунного ответа, которые привели к смерти людей и развитию лейкемии в клинических испытаниях. Обход потребности в векторах с использованием голой или плазмидной ДНК в качестве собственной системы доставки также сталкивается с такими проблемами, как низкая эффективность трансдукции и плохой тканевой таргетинг при системном применении.
Искусственные клетки были предложены в качестве невирусного вектора, посредством которого инкапсулировали и имплантировали генетически модифицированные неавтологичные клетки для доставки рекомбинантных белков in vivo. Этот тип иммуноизоляции оказался эффективным у мышей за счет доставки искусственных клеток, содержащих мышиный гормон роста, который спасет задержку роста у мутантных мышей. Несколько стратегий продвинулись к клиническим испытаниям человека для лечения рака поджелудочной железы, бокового склероза и контроля боли.
гемоперфузия
Первое клиническое использование искусственных клеток было в гемоперфузии путем инкапсуляции активированного угля. Активированный уголь обладает способностью адсорбировать многие крупные молекулы и давно известен своей способностью удалять токсичные вещества из крови при случайном отравлении или передозировке. Однако перфузия через прямое введение древесного угля является токсичной, поскольку она приводит к эмболиям и повреждению клеток крови с последующим удалением тромбоцитами. Искусственные клетки позволяют токсинам диффундировать в клетку, сохраняя опасный груз в их ультратонкой мембране.
Гемоперфузия искусственных клеток была предложена как менее дорогостоящий и более эффективный способ детоксикации, чем гемодиализ, при котором фильтрация крови происходит только путем разделения размеров физической мембраной. В гемоперфузии тысячи искусственных клеток адсорбента сохраняются внутри небольшого контейнера за счет использования двух экранов с обоих концов, через которые переносится кровь пациента. По мере циркуляции крови токсины или лекарства диффундируют в клетки и сохраняются поглощающим материалом. Мембраны искусственных клеток намного тоньше, чем те, которые используются в диализе, и их малый размер означает, что они имеют высокую площадь поверхности мембраны. Это означает, что часть ячейки может иметь теоретический массоперенос, который в сто раз выше, чем у всей искусственной почки. Устройство было установлено как обычный клинический метод для пациентов, получавших случайное или самоубийственное отравление, но также было введено как терапия при печеночной недостаточности и почечной недостаточности, выполняя часть функции этих органов. Гемоперфузия искусственных клеток также была предложена для использования в иммуноадсорбции, посредством которой антитела могут быть удалены из организма путем прикрепления иммуноадсорбирующего материала, такого как альбумин, на поверхности искусственных клеток. Этот принцип был использован для удаления антител группы крови из плазмы для трансплантации костного мозга и для лечения гиперхолестеринемии с помощью моноклональных антител для удаления липопротеинов низкой плотности. Гемоперфузия особенно полезна в странах со слабым производством гемодиализа, поскольку устройства, как правило, там дешевле и используются в пациентах с почечной недостаточностью.
Инкапсулированные ячейки
Наиболее распространенным методом получения искусственных клеток является инкапсуляция клеток. Инкапсулированные клетки обычно достигаются путем генерирования капель контролируемого размера из суспензии жидких клеток, которые затем быстро затвердевают или желатинизируют для обеспечения дополнительной стабильности. Стабилизация может быть достигнута путем изменения температуры или сшивки материала. Микроокружение, которое клетка видит, изменяется при инкапсуляции. Обычно он переходит от монослоя к суспензии в полимерном каркасе внутри полимерной мембраны. Недостатком метода является то, что инкапсуляция клетки снижает ее жизнеспособность и способность размножаться и дифференцироваться. Кроме того, через некоторое время внутри микрокапсулы клетки образуют кластеры, которые ингибируют обмен кислорода и метаболических отходов, что приводит к апоптозу и некрозу, что ограничивает эффективность клеток и активирует иммунную систему хозяина. Искусственные клетки были успешными для трансплантации ряда клеток, включая островки Лангерганса для лечения диабета, клетки паращитовидной железы и клетки коры надпочечников.
Инкапсулированные гепатоциты
Нехватка доноров органов делает искусственные клетки ключевыми игроками в альтернативных методах лечения печеночной недостаточности. Использование искусственных клеток для трансплантации гепатоцитов продемонстрировало осуществимость и эффективность в обеспечении функции печени в моделях заболевания печени животных и биоархивированных печеночных устройствах. Исследования вызвали эксперименты, в которых гепатоциты были прикреплены к поверхности микроносителей и превратились в гепатоциты, которые инкапсулированы в трехмерную матрицу в альгинатные микрокапли, покрытые внешней оболочкой полилизина. Ключевым преимуществом этого способа доставки является обход иммуносупрессивной терапии в течение всего периода лечения. Инкапсуляции гепатоцитов были предложены для использования в биоартифической печени. Устройство состоит из цилиндрической камеры, в которую встроены изолированные гепатоциты, через которые пациент плазма циркулирует внекорпорально в виде гемоперфузии. Поскольку микрокапсулы имеют высокое отношение площади поверхности к объему, они обеспечивают большую поверхность для диффузии субстрата и могут вместить большое количество гепатоцитов. Лечение индуцированных мышей с печеночной недостаточностью показало значительное увеличение скорости выживания. Искусственные системы печени все еще находятся в раннем развитии, но демонстрируют потенциал для пациентов, ожидающих трансплантации органов, или когда собственная печень пациента восстанавливается достаточно, чтобы возобновить нормальную функцию. До сих пор клинические испытания с использованием искусственных печеночных систем и трансплантации гепатоцитов при конечных стадиях заболевания печени показали улучшение показателей здоровья, но еще не улучшили выживаемость. Основными препятствиями являются короткая долговечность и агрегация искусственных гепатоцитов после трансплантации. Гепатоциты, инкапсулированные с помощью стволовых клеток, демонстрируют большую жизнеспособность в культуре, и после имплантации и имплантации только искусственных стволовых клеток также показана регенерация печени. Поскольку такой интерес возник в использовании стволовых клеток для инкапсуляции в регенеративной медицине.
Инкапсулированные бактериальные клетки
Было предложено пероральное употребление колоний живых бактерий, и в настоящее время проводится терапия модуляции микрофлоры кишечника, профилактики диарейных заболеваний, лечения инфекций H.pylori, воспалений атопии, непереносимости лактозы и иммунной модуляции, среди прочих. Предлагаемый механизм действия не полностью понят, но, как полагают, имеет два основных эффекта. Во-первых, это питательный эффект, в котором бактерии конкурируют с токсинами, продуцирующими бактерии. Второй — это санитарный эффект, который стимулирует устойчивость к колонизации и стимулирует иммунный ответ. Устная доставка бактериальных культур часто является проблемой, поскольку они нацелены на иммунную систему и часто разрушаются при пероральном приеме. Искусственные клетки помогают решать эти проблемы, обеспечивая мимикрию в организме и селективное или долгосрочное высвобождение, тем самым повышая жизнеспособность бактерий, достигающих желудочно-кишечной системы. Кроме того, инкапсулирование живых бактерий может быть сконструировано таким образом, чтобы позволить диффузию малых молекул, включая пептиды, в организм для терапевтических целей. Мембраны, которые оказались успешными для доставки бактерий, включают ацетат целлюлозы и варианты альгината. Дополнительные применения, которые имеют арозен от инкапсуляции бактериальных клеток, включают защиту от заражения M. tuberculosis и повышение активности Ig, секретирующих клетки иммунной системы. Эта технология ограничена рисками системных инфекций, неблагоприятной метаболической активности и риска передачи генов. Однако большая проблема заключается в доставке достаточного количества жизнеспособных бактерий в интересующий сайт.
Искусственные клетки крови
Кислородные носители
Наноразмерные кислородные носители используются как тип заменителей эритроцитов, хотя у них нет других компонентов эритроцитов. Они состоят из синтетической полимерсомы или искусственной мембраны, окружающей очищенное животное, человека или рекомбинантный гемоглобин. В целом, доставка гемоглобина по-прежнему является проблемой, потому что она очень токсична при доставке без каких-либо изменений. В некоторых клинических испытаниях вазопрессорные эффекты наблюдались для заменителей крови гемоглобина первого поколения.
красные кровяные тельца
Научный интерес к использованию искусственных клеток для крови возник после эпидемии СПИДа 1980-х годов. Кроме того, в обход потенциала для передачи болезни необходимы искусственные эритроциты, поскольку они устраняют недостатки, связанные с аллогенными переливаниями крови, такими как кровь, иммунные реакции и короткий срок хранения 42 дня. Замену гемоглобина можно хранить при комнатной температуре, а не при охлаждении более чем на год. Были предприняты попытки разработать полный рабочий эритроцит, который содержит углекислый не только носитель кислорода, но и ферменты, связанные с клеткой. Первая попытка была сделана в 1957 году путем замены мембраны красных кровяных телец ультратонкой полимерной мембраной, за которой следовало инкапсулирование через липидную мембрану, а в последнее время и биоразлагаемую полимерную мембрану. Биологическую мембрану эритроцитов, включая липиды и связанные с ней белки, можно также использовать для инкапсулирования наночастиц и увеличения времени пребывания in vivo путем обхода поглощения макрофагов и системного разминирования.
Leuko-polymersome
Лейкополимерсома представляет собой полимерсому, сконструированную с адгезионными свойствами лейкоцитов. Полимеры представляют собой везикулы, состоящие из двухслойного листа, который может инкапсулировать многие активные молекулы, такие как лекарственные средства или ферменты. Добавляя адгезионные свойства лейкоцитов к их мембранам, их можно заставить замедлить или прокатиться вдоль эпителиальных стенок в быстротекущей системе кровообращения.
Синтетические клетки
Минимальная ячейка
Немецкий патологоанатом Рудольф Вирхов привел идею о том, что жизнь не только возникает из клеток, но и каждая клетка исходит из другой клетки; «Omnis cellula e cellula». До сих пор большинство попыток создания искусственной ячейки создали пакет, который может имитировать определенные задачи ячейки. Достижения в бесклеточной реакции транскрипции и трансляции позволяют выражать многие гены, но эти усилия далеки от создания полностью функциональной клетки.
Будущее заключается в создании проточеек или ячейки, которая имеет все минимальные требования к жизни. Члены Института Дж. Крейга Вентера использовали сверху вниз вычислительный подход для выбивания генов в живом организме до минимального набора генов. В 2010 году команде удалось создать реплицирующий штамм Mycoplasma mycoides (Mycoplasma laboratorium) с использованием синтетически созданной ДНК, которая считается минимальным требованием для жизни, которое было введено в геномно-пустую бактерию. Следует надеяться, что процесс биосинтеза сверху вниз позволит вводить новые гены, которые будут выполнять выгодные функции, такие как образование водорода для топлива или захват избытка углекислого газа в атмосфере. множество нормативных, метаболических и сигнальных сетей не полностью охарактеризованы. Эти нисходящие подходы имеют ограничения для понимания фундаментальной молекулярной регуляции, поскольку организмы-хозяева имеют сложный и неполностью определенный молекулярный состав.
Восходящий подход к построению искусственной клетки предполагает создание проточелла de novo, полностью из неживых материалов. Предлагается создать фосфолипидный бислойный пузырь с ДНК, способной к самовоспроизводству с использованием синтетической генетической информации. Три первичных элемента таких искусственных клеток представляют собой формирование липидной мембраны, репликации ДНК и РНК через шаблонный процесс и сбор химической энергии для активного транспорта через мембрану. Основными препятствиями, предвиденными и встречающимися с этим предлагаемым проточетом, являются создание минимальной синтетической ДНК, которая содержит всю достаточную информацию для жизни и воспроизводство негенных генетических компонентов, которые являются неотъемлемой частью развития клеток, таких как молекулярная самоорганизация. Однако есть надежда, что подобный подход «снизу вверх» обеспечит понимание фундаментальных вопросов организаций на клеточном уровне и истоков биологической жизни. До сих пор полностью искусственная клетка, способная к самовоспроизводству, была синтезирована с использованием молекул жизни, и эта цель все еще находится в отдаленном будущем, хотя в настоящее время в этой области работают различные группы.
Другой метод, предложенный для создания проточелла, более близко напоминает условия, которые, как считается, присутствовали во время эволюции, известной как изначальный суп. Различные РНК-полимеры могут быть инкапсулированы в везикулы и в таких малых граничных условиях, для которых будут проверяться химические реакции.
Тяжелое инвестирование в биологии было сделано крупными компаниями, такими как ExxonMobil, которая сотрудничает с Synthetic Genomics Inc; Собственная биосинтетическая компания Craig Venter по разработке топлива из водорослей.
Электронная искусственная ячейка
Концепция электронной искусственной клетки была расширена в рамках трех проектов ЕС, координируемых Джоном МакКаскилом в 2004-2015 годах.
Европейская комиссия спонсировала разработку программы «Программируемая искусственная эволюция клеток» (ПАСЕ) с 2004-2008 годов, целью которой было заложить основу для создания «микроскопических самоорганизующихся, самовоспроизводящихся и эволюционирующих автономных объектов, построенных на основе простых органические и неорганические вещества, которые могут быть генетически запрограммированы для выполнения конкретных функций »для возможной интеграции в информационные системы. Проект PACE разработал первую систему Omega Machine, систему жизнеобеспечения микрожидкости для искусственных клеток, которая может дополнять химически отсутствующие функциональные возможности (как первоначально предлагали Норман Паккард, Стин Расмуссен, Марк Биадо и Джон Маккаскилл). Конечной целью было достижение эволюционирующей гибридной ячейки в сложной микромасштабной программируемой среде. Затем функции Омега-машины можно было удалить поэтапно, создавая ряд разрешимых эволюционных задач для искусственной химии клеток. Проект обеспечил химическую интеграцию до уровня пар трех основных функций искусственных клеток (генетическая подсистема, система удержания и метаболическая система) и создал новые пространственно разрешенные программируемые микрожидкостные среды для интеграции локализации и генетического усиления. «Программируемая эволюция искусственных клеток» (PACE) Проект привел к созданию Европейского центра живых технологий], который в настоящее время продолжает аналогичные исследования.
После этого исследования, в 2007 году, Джон МакКаскилл предложил сосредоточиться на электронно-дополненной искусственной ячейке, называемой Electronic Chemical Cell. Основная идея заключалась в том, чтобы использовать массивную параллельную решетку электродов, соединенных с локально выделенными электронными схемами, в двухмерной тонкой пленке в дополнение к новым химическим свойствам ячейки. Локальная электронная информация, определяющая схемы переключения электродов и зондирования, может служить в качестве электронного генома, дополняя молекулярную последовательную информацию в новых протоколах. Предложение по проведению исследований было успешным с Европейской комиссией, и международная группа ученых, частично перекрывающаяся с консорциумом ПАСЕ, начала работу в 2008-2012 годах по проекту «Электронные химические ячейки». Проект продемонстрировал, среди прочего, что электронно управляемый локальный перенос конкретных последовательностей может быть использован в качестве искусственной системы пространственного контроля для генетической пролиферации будущих искусственных клеток и что основные процессы метаболизма могут быть доставлены электродами с соответствующим покрытием.
Основным ограничением этого подхода, помимо первоначальных трудностей в освоении микромасштабной электрохимии и электрокинетики, является то, что электронная система взаимосвязана как жесткая неавтономная часть макроскопического оборудования. В 2011 году Маккаскилл предложил инвертировать геометрию электроники и химии: вместо того, чтобы размещать химикаты в активной электронной среде, разместить микроскопическую автономную электронику в химической среде. Он организовал проект по борьбе с электронными искусственными клетками третьего поколения в масштабе 100 мкм, которые могли бы самособираться из двух полуклеточных «лабилей», чтобы заключить внутреннее химическое пространство, и работать с помощью активной электроники, питаемой средой они погружены. Такие ячейки могут копировать как их электронное, так и химическое содержимое и будут способны к эволюции в пределах ограничений, предоставляемых их специальными предварительно синтезированными микроскопическими строительными блоками. В сентябре 2012 года началась работа над этим проектом Microscale Chemically Reactive Electronic Agents.
Этика и споры
Исследования Protocell создали противоречивые и противоречивые мнения, в том числе критики неопределенного определения «искусственной жизни». Создание основной единицы жизни является наиболее насущной этической проблемой, хотя наиболее распространенным беспокойством о протоэллах является их потенциальная угроза здоровью людей и окружающей среде через неконтролируемое тиражирование.