Uma célula artificial ou célula mínima é uma partícula modificada que imita uma ou várias funções de uma célula biológica. O termo não se refere a uma entidade física específica, mas sim à idéia de que certas funções ou estruturas de células biológicas podem ser substituídas ou suplementadas por uma entidade sintética. Freqüentemente, as células artificiais são membranas biológicas ou poliméricas que contêm materiais biologicamente ativos. Como tal, nanopartículas, lipossomas, polimersomos, microcápsulas e um número de outras partículas se qualificaram como células artificiais. A microencapsulação permite o metabolismo dentro da membrana, a troca de pequenas moléculas e a prevenção da passagem de grandes substâncias através dela. As principais vantagens do encapsulamento incluem mimetismo aprimorado no corpo, aumento da solubilidade da carga e diminuição das respostas imunológicas. Notavelmente, as células artificiais foram clinicamente bem sucedidas na hemoperfusão.
Na área da biologia sintética, uma célula artificial “viva” foi definida como uma célula completamente sintética que pode capturar energia, manter gradientes iônicos, conter macromoléculas, armazenar informações e ter a capacidade de sofrer mutações. Tal célula ainda não é tecnicamente viável, mas foi criada uma variação de uma célula artificial na qual um genoma completamente sintético foi introduzido em células hospedeiras genomicamente esvaziadas. Embora não seja completamente artificial porque os componentes citoplasmáticos, bem como a membrana da célula hospedeira são mantidos, a célula modificada está sob o controle de um genoma sintético e é capaz de se replicar.
História
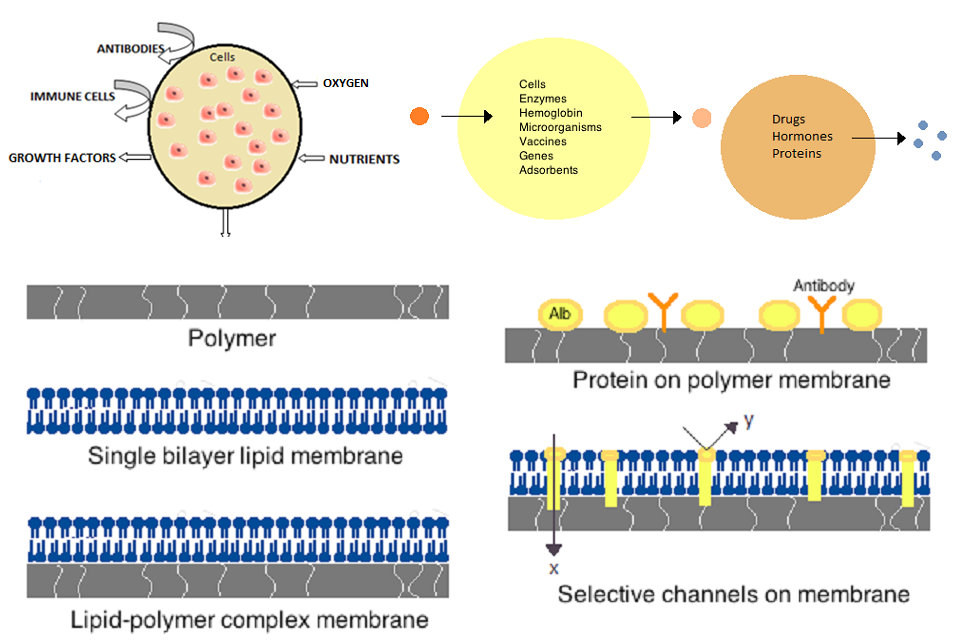
As primeiras células artificiais foram desenvolvidas por Thomas Chang na Universidade McGill na década de 1960. Estas células consistiam de membranas ultrafinas de nylon, colódio ou proteína reticulada cujas propriedades semipermeáveis permitiam a difusão de pequenas moléculas dentro e fora da célula. Estas células tinham micron de tamanho e continham células, enzimas, hemoglobina, materiais magnéticos, adsorventes e proteínas.
Mais tarde, as células artificiais variaram de dimensões de cem micrômetros a nanômetros e podem conter microrganismos, vacinas, genes, drogas, hormônios e peptídeos. O primeiro uso clínico de células artificiais foi na hemoperfusão pelo encapsulamento do carvão ativado.
Na década de 1970, os pesquisadores foram capazes de introduzir enzimas, proteínas e hormônios a microcápsulas biodegradáveis, levando posteriormente ao uso clínico em doenças como a síndrome de Lesch-Nyhan. Embora a pesquisa inicial de Chang tenha se concentrado em hemácias artificiais, apenas em meados da década de 1990 foram desenvolvidos glóbulos vermelhos artificiais biodegradáveis. Células artificiais em encapsulação de células biológicas foram usadas pela primeira vez na clínica em 1994 para tratamento em um paciente diabético e desde então outros tipos de células, como hepatócitos, células-tronco adultas e células geneticamente modificadas foram encapsuladas e estão em estudo para uso em regeneração de tecidos. .
Em 29 de dezembro de 2011, químicos da Universidade de Harvard relataram a criação de uma membrana celular artificial.
Em 2014, células bacterianas sintéticas auto-replicantes com paredes celulares e DNA sintético foram produzidas. Em janeiro daquele ano, os pesquisadores produziram uma célula eucariótica artificial capaz de realizar múltiplas reações químicas por meio de organelas ativas.
Em setembro de 2018, pesquisadores da Universidade da Califórnia desenvolveram células artificiais que podem matar bactérias. As células foram projetadas de baixo para cima – como blocos de Lego – para destruir bactérias.
Materiais
As membranas para células artificiais são feitas de polímeros simples, proteínas reticuladas, membranas lipídicas ou complexos polímero-lipídico. Além disso, as membranas podem ser manipuladas para apresentar proteínas de superfície, tais como albumina, antigénios, portadores de Na / K-ATPase, ou poros, tais como canais de iões. Materiais comumente usados para a produção de membranas incluem polímeros de hidrogel, como alginato, celulose e polímeros termoplásticos, como metacrilato de hidroxietil metacrilato (HEMA-MMA), cloreto de poliacrilonitrila-polivinila (PAN-PVC), bem como variações do acima mencionado. mencionado. O material utilizado determina a permeabilidade da membrana celular, que para o polímero depende do peso molecular cortado (MWCO). O MWCO é o peso molecular máximo de uma molécula que pode passar livremente pelos poros e é importante para determinar a difusão adequada de nutrientes, resíduos e outras moléculas críticas. Polímeros hidrofílicos têm o potencial de serem biocompatíveis e podem ser fabricados em uma variedade de formas que incluem micelas poliméricas, misturas sol-gel, misturas físicas e partículas reticuladas e nanopartículas. De especial interesse são polímeros responsivos a estímulos que respondem a mudanças de pH ou temperatura para uso em entrega direcionada. Estes polímeros podem ser administrados na forma líquida através de uma injecção macroscópica e solidificar ou gel in situ devido à diferença de pH ou temperatura. Preparações de nanopartículas e lipossomas também são rotineiramente usadas para encapsulação e entrega de materiais. Uma grande vantagem dos lipossomas é a sua capacidade de se fundirem às membranas das células e organelas.
Preparação
Muitas variações para preparação e encapsulamento de células artificiais foram desenvolvidas. Tipicamente, vesículas como nanopartículas, polimersomos ou lipossomos são sintetizadas. Uma emulsão é tipicamente feita através do uso de equipamento de alta pressão, como um homogeneizador de alta pressão ou um microfluidificador. Dois métodos de micro-encapsulação para nitrocelulose são também descritos abaixo.
Homogeneização a alta pressão
Em um homogeneizador de alta pressão, dois líquidos em suspensão óleo / líquido são forçados através de um pequeno orifício sob pressão muito alta. Este processo divide os produtos e permite a criação de partículas extremamente finas, tão pequenas quanto 1 nm.
Microfluidização
Essa técnica usa um Microfluidificador patenteado para obter uma quantidade maior de suspensões homogêneas que podem criar partículas menores que homogeneizadores. Um homogeneizador é primeiro usado para criar uma suspensão grossa que é então bombeada para o microfluidificador sob alta pressão. O fluxo é então dividido em duas correntes que reagirão a velocidades muito altas em uma câmara de interação até que o tamanho de partícula desejado seja obtido. Esta técnica permite a produção em larga escala de lipossomas fosfolipídicos e subsequentes nanoencapsulações de material.
Método de queda
Neste método, uma solução de células é incorporada gota a gota numa solução de colódio de nitrato de celulose. À medida que a gota viaja através do colódio, é revestida com uma membrana graças às propriedades de polimerização interfacial do colódio. A célula depois se estabelece em parafina onde a membrana se fixa e finalmente é suspensa uma solução salina. O método da gota é usado para a criação de grandes células artificiais que encapsulam células biológicas, células-tronco e células-tronco geneticamente modificadas.
Método de emulsão
O método de emulsão difere na medida em que o material a ser encapsulado é geralmente menor e é colocado no fundo de uma câmara de reação onde o colódio é adicionado no topo e centrifugado, ou perturbado de qualquer outra forma para criar uma emulsão. O material encapsulado é então disperso e suspenso em solução salina.
Relevância clinica
Libertação e entrega de medicamentos
Células artificiais usadas para administração de drogas diferem de outras células artificiais, pois seu conteúdo é destinado a difundir para fora da membrana, ou ser englobado e digerido por uma célula alvo hospedeira. Freqüentemente usadas são células artificiais de membrana lipídica submicrônicas que podem ser chamadas de nanocápsulas, nanopartículas, polimersomos ou outras variações do termo.
Terapia enzimática
A terapia enzimática está sendo ativamente estudada para doenças metabólicas genéticas em que uma enzima é superexpressa, sub-expressa, defeituosa ou não existe. No caso de sub-expressão ou expressão de uma enzima defeituosa, uma forma ativa da enzima é introduzida no corpo para compensar o déficit. Por outro lado, uma superexpressão enzimática pode ser neutralizada pela introdução de uma enzima não funcional concorrente; isto é, uma enzima que metaboliza o substrato em produtos não ativos. Quando colocadas dentro de uma célula artificial, as enzimas podem realizar sua função por um período muito mais longo em comparação com as enzimas livres e podem ser ainda mais otimizadas pela conjugação de polímeros.
A primeira enzima estudada sob encapsulamento celular artificial foi a asparaginase para o tratamento do linfossarcoma em camundongos. Este tratamento atrasou o início e o crescimento do tumor. Estas descobertas iniciais levaram a novas pesquisas no uso de células artificiais para entrega de enzimas em melanomas dependentes de tirosina. Esses tumores têm uma maior dependência da tirosina do que as células normais para o crescimento, e pesquisas mostraram que a redução dos níveis sistêmicos de tirosina em camundongos pode inibir o crescimento de melanomas. O uso de células artificiais na entrega de tirosinase; e a enzima que digere a tirosina, permite uma melhor estabilidade enzimática e mostra-se eficaz na remoção da tirosina sem os graves efeitos colaterais associados à depravação da tirosina na dieta.
A terapia enzimática com células artificiais também é de interesse para a ativação de pró-fármacos, como a ifosfamida, em certos tipos de câncer. As células artificiais que encapsulam a enzima citocromo p450 que converte esta pró-droga no fármaco activo podem ser adaptadas para se acumularem no carcinoma pancreático ou para implantar as células artificiais perto do local do tumor. Aqui, a concentração local da ifosfamida ativada será muito maior do que no resto do corpo, evitando assim a toxicidade sistêmica. O tratamento foi bem sucedido em animais e mostrou uma duplicação na sobrevida mediana entre os pacientes com câncer de pâncreas em estágio avançado em ensaios clínicos de fase I / II, e uma triplicação em um ano de taxa de sobrevivência.
Terapia de genes
No tratamento de doenças genéticas, a terapia genética visa inserir, alterar ou remover genes dentro das células de um indivíduo afetado. A tecnologia baseia-se fortemente em vetores virais, o que levanta preocupações sobre mutagênese insercional e resposta imune sistêmica que levaram à morte humana e ao desenvolvimento de leucemia em estudos clínicos. Contornar a necessidade de vetores usando DNA nu ou plasmídeo como seu próprio sistema de entrega também encontra problemas como baixa eficiência de transdução e má segmentação de tecido quando administrado sistemicamente.
Culas artificiais foram propostas como um vector n viral pelo qual culas n autogas geneticamente modificadas s encapsuladas e implantadas para distribuir proteas recombinantes in vivo. Este tipo de isolamento imunológico tem se mostrado eficiente em camundongos através da entrega de células artificiais contendo hormônio de crescimento de camundongos que resgataram um retardo de crescimento em camundongos mutantes. Algumas estratégias avançaram para ensaios clínicos em humanos para o tratamento do câncer de pâncreas, esclerose lateral e controle da dor.
Hemoperfusão
O primeiro uso clínico de células artificiais foi na hemoperfusão pelo encapsulamento do carvão ativado. O carvão ativado tem a capacidade de absorver muitas moléculas grandes e é conhecido há muito tempo por sua capacidade de remover substâncias tóxicas do sangue em intoxicações acidentais ou em superdosagens. No entanto, a perfusão através da administração direta de carvão é tóxica, pois leva a embolias e danos às células sanguíneas, seguidas da remoção pelas plaquetas. Células artificiais permitem que as toxinas se difundam na célula enquanto mantêm a carga perigosa dentro de sua membrana ultrafina.
A hemoperfusão de células artificiais tem sido proposta como uma opção desintoxicante menos custosa e mais eficiente do que a hemodiálise, na qual a filtragem do sangue ocorre apenas através da separação do tamanho por uma membrana física. Na hemoperfusão, milhares de células artificiais adsorventes são retidas dentro de um pequeno recipiente através do uso de duas telas em cada extremidade, através das quais o sangue do paciente perfunde. À medida que o sangue circula, toxinas ou drogas se difundem para as células e são retidas pelo material absorvente. As membranas de células artificiais são muito mais finas que aquelas usadas em diálise e seu pequeno tamanho significa que elas têm uma área de superfície de membrana alta. Isso significa que uma parte da célula pode ter uma transferência de massa teórica que é cem vezes maior do que a de uma máquina de rim artificial inteira. O dispositivo foi estabelecido como um método clínico de rotina para pacientes tratados por envenenamento acidental ou suicida, mas também foi introduzido como terapia na insuficiência hepática e na insuficiência renal por meio da realização de parte da função desses órgãos. A hemoperfusão de células artificiais foi também proposta para utilização em imunoadsorção, através da qual os anticorpos podem ser removidos do corpo por meio da ligação de um material imunoadsorvente, tal como a albumina, na superfície das células artificiais. Este princípio tem sido usado para remover anticorpos do grupo sanguíneo do plasma para transplante de medula óssea e para o tratamento de hipercolesterolemia através de anticorpos monoclonais para remover lipoproteínas de baixa densidade. A hemoperfusão é especialmente útil em países com uma indústria manufatureira de hemodiálise fraca, já que os dispositivos tendem a ser mais baratos e usados em pacientes com insuficiência renal.
Células encapsuladas
O método mais comum de preparação de células artificiais é através do encapsulamento celular. As células encapsuladas são tipicamente obtidas através da geração de gotículas de tamanho controlado a partir de uma suspensão de células líquidas que são então rapidamente solidificadas ou geladas para proporcionar estabilidade adicional. A estabilização pode ser alcançada através de uma mudança na temperatura ou através de reticulação de material. O microambiente que uma célula vê muda no encapsulamento. Normalmente, ela vai de uma monocamada a uma suspensão em um andaime de polímero dentro de uma membrana polimérica. Uma desvantagem da técnica é que encapsular uma célula diminui sua viabilidade e capacidade de proliferar e diferenciar. Além disso, após algum tempo dentro da microcápsula, as células formam aglomerados que inibem a troca de oxigênio e resíduos metabólicos, levando à apoptose e necrose, limitando assim a eficácia das células e ativando o sistema imunológico do hospedeiro. Células artificiais têm sido bem sucedidas para o transplante de várias células, incluindo ilhotas de Langerhans para tratamento de diabetes, células paratireóides e células do córtex adrenal.
Hepatócitos encapsulados
A escassez de doadores de órgãos torna as células artificiais atores-chave em terapias alternativas para a insuficiência hepática. O uso de células artificiais para o transplante de hepatócitos demonstrou viabilidade e eficácia no fornecimento de função hepática em modelos de doenças do fígado de animais e dispositivos hepáticos bioartificiais. A pesquisa resultou de experimentos em que os hepatócitos foram anexados à superfície de um micro-portador e evoluiu para hepatócitos que são encapsulados em uma matriz tridimensional em microgotas de alginato cobertos por uma camada externa de polilisina. Uma vantagem chave para este método de entrega é a evasão da terapia de imunossupressão durante o tratamento. Encapsulamentos de hepatócitos têm sido propostos para uso em um fígado bioartificial. O dispositivo consiste em uma câmara cilíndrica embutida com hepatócitos isolados, através dos quais o plasma do paciente é circulado de forma extra corpórea em um tipo de hemoperfusão. Como as microcápsulas têm uma alta razão de área superficial para volume, elas fornecem grande superfície para a difusão do substrato e podem acomodar um grande número de hepatócitos. O tratamento para camundongos com insuficiência hepática induzida mostrou um aumento significativo na taxa de sobrevida. Os sistemas artificiais do fígado ainda estão em desenvolvimento inicial, mas mostram potencial para pacientes que esperam pelo transplante de órgão ou enquanto o próprio fígado do paciente se regenera o suficiente para retomar a função normal. Até agora, ensaios clínicos utilizando sistemas de fígado artificial e transplante de hepatócitos em doenças hepáticas em estágio terminal mostraram melhora dos marcadores de saúde, mas ainda não melhoraram a sobrevida. A curta longevidade e agregação de hepatócitos artificiais após o transplante são os principais obstáculos encontrados. Hepatócitos co-encapsulados com células-tronco apresentam maior viabilidade em cultura e após implantação e implantação de células-tronco artificiais isoladamente também mostraram regeneração hepática. Como tal interesse surgiu no uso de células-tronco para encapsulamento na medicina regenerativa.
Células bacterianas encapsuladas
A ingestão oral de colônias de células bacterianas vivas foi proposta e está atualmente em terapia para a modulação da microflora intestinal, prevenção de doenças diarreicas, tratamento de infecções por H. pylori, inflamações atópicas, intolerância à lactose e modulação imune, entre outras. O mecanismo de ação proposto não é totalmente compreendido, mas acredita-se que tenha dois efeitos principais. O primeiro é o efeito nutricional, no qual as bactérias competem com bactérias produtoras de toxinas. O segundo é o efeito sanitário, que estimula a resistência à colonização e estimula a resposta imune. O fornecimento oral de culturas bacterianas é muitas vezes um problema porque são alvos do sistema imunitário e frequentemente destruídos quando tomados por via oral. Células artificiais ajudam a resolver esses problemas, fornecendo mimetismo no corpo e liberação seletiva ou de longo prazo, aumentando assim a viabilidade de bactérias que chegam ao sistema gastrointestinal. Além disso, a encapsulação de células bacterianas vivas pode ser projetada para permitir a difusão de pequenas moléculas, incluindo peptídeos, para o corpo para fins terapêuticos. Membranas que provaram ser bem sucedidas para entrega bacteriana incluem acetato de celulose e variantes de alginato. Utilizaes adicionais que surgiram da encapsulao de culas bacterianas incluem proteco contra o desafio de M. Tuberculosis e regulao positiva de culas secretoras de Ig do sistema imunitio. A tecnologia é limitada pelo risco de infecções sistêmicas, atividades metabólicas adversas e risco de transferência de genes. No entanto, o maior desafio continua sendo a entrega de bactérias viáveis suficientes para o local de interesse.
Glóbulos artificiais
Transportadores de oxigênio
Portadores de oxigênio de tamanho nanométrico são usados como um tipo de substituto de glóbulos vermelhos, embora eles não tenham outros componentes dos glóbulos vermelhos. Eles são compostos de um polimossomo sintético ou uma membrana artificial envolvendo hemoglobina animal, humana ou recombinante purificada. No geral, a entrega de hemoglobina continua a ser um desafio porque é altamente tóxico quando administrada sem quaisquer modificações. Em alguns ensaios clínicos, foram observados efeitos vasopressores para os substitutos sanguíneos da hemoglobina de primeira geração.
glóbulos vermelhos
Interesse de pesquisa no uso de células artificiais para o sangue surgiu após o medo da AIDS dos anos 80. Além de evitar o potencial de transmissão da doença, os glóbulos vermelhos são desejados porque eliminam as desvantagens associadas às transfusões de sangue alogênico, como tipagem sanguínea, reações imunológicas e sua curta vida útil de 42 dias. Um substituto da hemoglobina pode ser armazenado à temperatura ambiente e não sob refrigeração por mais de um ano. Têm sido feitas tentativas para desenvolver um glóbulo vermelho em funcionamento completo que compreenda não só um transportador de oxigénio como também as enzimas associadas à célula. A primeira tentativa foi feita em 1957, substituindo a membrana das células vermelhas do sangue por uma membrana polimérica ultrafina, que foi seguida por encapsulação através de uma membrana lipídica e, mais recentemente, por uma membrana polimérica biodegradável. Uma membrana biológica de glóbulos vermelhos incluindo lípidos e proteínas associadas pode também ser utilizada para encapsular nanopartículas e aumentar o tempo de permanência in vivo evitando a absorção de macrófagos e a depuração sistémica.
Leuko-polymersome
Um leuko-polymersome é um polimersomo projetado para ter as propriedades adesivas de um leucócito. Os polimersomos são vesículas compostas por uma camada de bicamada que pode encapsular muitas moléculas ativas, como drogas ou enzimas. Ao adicionar as propriedades adesivas de um leucócito às suas membranas, elas podem diminuir a velocidade, ou rolar ao longo das paredes epiteliais dentro do sistema circulatório que flui rapidamente.
Células Sintéticas
A célula mínima
O patologista alemão Rudolf Virchow apresentou a ideia de que não apenas a vida surge das células, mas toda célula vem de outra célula; “Omnis cellula e cellula”. Até agora, a maioria das tentativas de criar uma célula artificial criou apenas um pacote que pode imitar certas tarefas da célula. Os avanços nas reações de transcrição e tradução livres de células permitem a expressão de muitos genes, mas esses esforços estão longe de produzir uma célula totalmente operacional.
O futuro está na criação de uma protocélula, ou uma célula que tenha todos os requisitos mínimos para a vida. Membros do Instituto J. Craig Venter usaram uma abordagem computacional de cima para baixo para derrubar genes em um organismo vivo a um conjunto mínimo de genes. Em 2010, a equipe conseguiu criar uma cepa replicadora de Mycoplasma mycoides (Mycoplasma laboratorium) usando DNA sinteticamente criado, considerado o requisito mínimo para a vida, que foi inserido em uma bactéria genômica vazia. Espera-se que o processo de biossíntese top-down permita a inserção de novos genes que desempenhem funções lucrativas, como a geração de hidrogênio para combustível ou a captura de excesso de dióxido de carbono na atmosfera. as inúmeras redes reguladoras, metabólicas e de sinalização não são completamente caracterizadas. Essas abordagens top-down têm limitações para o entendimento da regulação molecular fundamental, uma vez que os organismos hospedeiros possuem uma composição molecular complexa e incompletamente definida.
Uma abordagem de baixo para cima para construir uma célula artificial envolveria a criação de uma protocélula de novo, inteiramente a partir de materiais não vivos. Propõe-se criar uma vesícula de bicamada fosfolipídica com DNA capaz de se auto-reproduzir usando informações genéticas sintéticas. Os tr elementos primios de tais culas artificiais s a formao de uma membrana lipica, replicao de ADN e ARN atrav de um processo modelo e a recolha de energia quica para transporte activo atrav da membrana. Os principais obstáculos previstos e encontrados com essa proposta de protocélula são a criação de um DNA sintético mínimo que contenha toda a informação suficiente para a vida, e a reprodução de componentes não genéticos que sejam parte integrante do desenvolvimento celular, como a auto-organização molecular. No entanto, espera-se que esse tipo de abordagem de baixo para cima forneça insights sobre as questões fundamentais das organizações no nível celular e as origens da vida biológica. Até agora, nenhuma célula completamente artificial capaz de auto-reprodução foi sintetizada usando as moléculas da vida, e este objetivo ainda está em um futuro distante, embora vários grupos estejam trabalhando atualmente para esse objetivo.
Outro método proposto para criar uma protocélula se assemelha mais às condições que se acreditava estarem presentes durante a evolução conhecida como sopa primordial. Vários polímeros de RNA poderiam ser encapsulados em vesículas e em condições de contorno tão pequenas, as reações químicas seriam testadas.
Investimentos pesados em biologia foram feitos por grandes empresas como a ExxonMobil, que fez parceria com a Synthetic Genomics Inc; Empresa de biossíntese de Craig Venter no desenvolvimento de combustível a partir de algas.
Célula artificial eletrônica
O conceito de uma Célula Artificial Eletrônica foi expandido em uma série de 3 projetos da UE coordenados por John McCaskill de 2004-2015.
A Comissão Européia patrocinou o desenvolvimento do programa “Evolução da Célula Artificial Programável” (PACE) de 2004-2008 cujo objetivo era estabelecer as bases para a criação de “entidades autónomas auto-organizáveis, auto-replicantes e evolutivas, construídas a partir de simples substâncias orgânicas e inorgânicas que podem ser geneticamente programadas para desempenhar funções específicas “para a eventual integração em sistemas de informação. O projeto PACE desenvolveu o primeiro Omega Machine, um sistema de suporte de vida microfluídica para células artificiais que poderia complementar as funcionalidades quimicamente ausentes (como originalmente proposto por Norman Packard, Steen Rasmussen, Mark Beadau e John McCaskill). O objetivo final era atingir uma célula híbrida evoluída em um ambiente programável em microescala complexo. As funções da Máquina Omega poderiam então ser removidas gradualmente, colocando uma série de desafios de evolução solucionáveis para a química celular artificial. O projeto alcançou a integração química até o nível de pares das três funções principais de células artificiais (um subsistema genético, um sistema de contenção e um sistema metabólico) e gerou novos ambientes microfluídicos programáveis espacialmente resolvidos para a integração de contenção e amplificação genética. “Evolução de Células Artificiais Programáveis” (PACE) O projeto levou à criação do centro europeu de tecnologias vivas], que agora continua com pesquisas similares.
Após esta pesquisa, em 2007, John McCaskill propôs concentrar-se em uma célula artificial complementada eletronicamente, chamada Electronic Chemical Cell. A idéia principal era usar um conjunto massivamente paralelo de eletrodos acoplados a circuitos eletrônicos localmente dedicados, em um filme fino bidimensional, para complementar a funcionalidade celular química emergente. A informação eletrônica local que define os circuitos de comutação e detecção de eletrodos poderia servir como um genoma eletrônico, complementando a informação seqüencial molecular nos protocolos emergentes. Uma proposta de pesquisa foi bem sucedida com a Comissão Europeia e uma equipe internacional de cientistas que se sobrepôs parcialmente ao consórcio PACE iniciou o trabalho de 2008 a 2012 no projeto Electronic Chemical Cells. O projeto demonstrou, entre outras coisas, que o transporte local controlado eletronicamente de sequências específicas poderia ser usado como um sistema de controle espacial artificial para a proliferação genética de futuras células artificiais, e que os processos centrais do metabolismo poderiam ser entregues adequadamente por matrizes de eletrodos revestidos.
A principal limitação dessa abordagem, além das dificuldades iniciais de dominar a eletroquímica e eletroquímica em microescala, é que o sistema eletrônico é interconectado como uma peça rígida não autônoma de hardware macroscópico. Em 2011, McCaskill propôs inverter a geometria da eletrônica e da química: em vez de colocar produtos químicos em um meio eletrônico ativo, colocar a eletrônica autônoma microscópica em um meio químico. Ele organizou um projeto para lidar com uma terceira geração de Células Artificiais Eletrônicas na escala de 100 µm que poderia se auto-montar a partir de duas meias-células para conter um espaço químico interno e funcionar com o auxílio de eletrônicos ativos alimentados pelo meio. eles estão imersos. Essas células podem copiar tanto seu conteúdo eletrônico quanto o químico e serão capazes de evoluir dentro das restrições fornecidas por seus blocos de construção microscópicos pré-sintetizados especiais. Em setembro de 2012 o trabalho começou neste projeto Microscale Chemically Reactive Electronic Agents.
Ética e controvérsia
A pesquisa de protocélulas criou controvérsia e opiniões opostas, incluindo críticas à definição vaga de “vida artificial”. A criação de uma unidade básica de vida é a preocupação ética mais premente, embora a preocupação mais difundida sobre as protocélulas seja sua ameaça potencial à saúde humana e ao meio ambiente por meio da replicação descontrolada.