발색단 (chromophore)은 색을 담당하는 분자의 일부입니다. 우리 눈에 보이는 색은 가시 광선의 특정 파장 스펙트럼 내에서 흡수되지 않는 색입니다. 발색단은 두 개의 분리 된 분자 궤도 사이의 에너지 차이가 가시 스펙트럼의 범위 내에있는 분자 내 영역이다. 발색단에 도달하는 가시 광선은 전자를 기저 상태에서 여기 상태로 자극함으로써 흡수 될 수있다.
빛 에너지를 포착하거나 탐지하는 역할을하는 생물학적 분자에서 발색단은 빛에 부딪 칠 때 분자의 구조 변화를 일으키는 부분입니다.
공액 pi-bond 시스템 발색단
공액 발색단에서, 전자는 종종 방향족 시스템에서 단일 및 이중 결합이 교대로 반복되어 생성되는 확장 된 π 오비탈 인 에너지 준위 사이에서 점프한다. 일반적인 예로는 망막 (빛을 탐지하기 위해 눈에 사용), 다양한 식품 착색제, 직물 염료 (아조 화합물), pH 지시약, 리코펜, β- 카로틴 및 안토시아닌이 있습니다. 발색단의 구조에서 다양한 인자는 발색단이 흡수 할 스펙트럼의 어떤 파장 영역에서 결정할 것입니다. 분자 내에 더 많은 불포화 (다중) 결합을 갖는 공액 시스템을 길게 늘리거나 연장 시키면 더 긴 파장으로 흡수가 이동하는 경향이 있습니다. Woodward-Fieser 규칙은 접합 된 파이 본드 시스템을 사용하여 유기 화합물에서 자외선 – 가시 최대 흡수 파장을 근사하는 데 사용할 수 있습니다.
이들 중 일부는 리간드와의 배위 착물 내에 금속을 함유하는 금속 착화 발색단이다. 엽록소는 식물이 광합성을 위해 사용하는 것으로, 척추 동물의 혈액에서 산소 운반체 인 헤모글로빈 (hemoglobin)입니다. 이 두 가지 예에서, 금속은 테플로 피롤 거대 고리의 중심에서 헤모글로빈의 헤메 그룹 (포르피린 고리의 철) 또는 클로로필의 경우 클로린 유형 링에서 착화 된 마그네슘 . 거대 고리 고리의 고 결합 된 파이 결합 시스템은 가시광을 흡수합니다. 중심 금속의 성질은 또한 금속 – 대 사이클 복합체의 흡수 스펙트럼 또는 여기 상태 수명과 같은 특성에 영향을 미칠 수있다. 거대 고리가 아니지만 공액 pi- 결합 시스템을 여전히 갖는 유기 화합물의 테트라 피롤 부분은 여전히 발색단으로서 작용한다. 이러한 화합물의 예는 황색을 나타내는 빌리루빈 및 우로 빌린을 포함한다.
보조색
auxochrome은 발색단에 부착 된 원자의 기능적 그룹으로 발색단이 빛을 흡수하여 흡수의 파장이나 강도를 변경합니다.
발색단에서의 Halochromism
Halochromism은 물질의 pH 변화에 따라 색이 변할 때 발생합니다. 이것은 주위의 pH 변화에 따라 분자 구조가 변하는 pH 지표의 특성입니다. 이 구조 변화는 pH 지시약 분자의 발색단에 영향을 미친다.예를 들어, 페놀프탈레인은 다음 표와 같이 pH가 변함에 따라 구조가 변하는 pH 표시기입니다.
| 구조 | 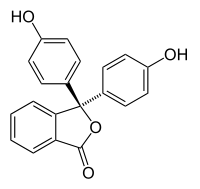 |
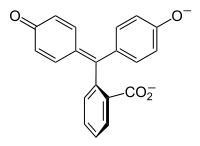 |
|---|---|---|
| pH | 0-8.2 | 8.2-12 |
| 정황 | 산성 또는 거의 중성 인 | 기본 |
| 색상 이름 | 무색의 | 분홍색에서 자홍색까지 |
| 색깔 |
약 0-8의 pH 범위에서, 분자는 방향족 고리 접합체에서 π 결합을 만들지 않는 중간의 사면체 sp3 혼성화 탄소 원자에 모두 결합 된 3 개의 방향족 고리를 갖는다. 제한된 범위로 인해 방향족 고리는 자외선 영역의 빛만 흡수하기 때문에 화합물은 0-8 pH 범위에서 무색으로 보인다. 그러나 pH가 8.2 이상으로 증가하면 중심 탄소는 sp2가 하이브리드 화되고 ap 오비탈이 고리의 π- 결합과 겹치게되는 이중 결합의 일부가됩니다. 이것은 3 개의 링을 함께 결합시켜 긴 파장의 가시 광선을 흡수하는 확장 된 발색단을 형성하여 자홍색을 나타낸다. pH 범위가 0-12을 벗어나면 다른 분자 구조 변화로 인해 다른 색 변화가 일어납니다. 자세한 내용은 페놀프탈레인 참조.