
印刷可能な器官は、3D印刷技術を使用して製造された器官置換用に設計された人工的に構成された装置である。 印刷可能な器官の主な目的は移植である。 現在、人工心臓、腎臓および肝臓の構造ならびに他の主要な器官についての研究が行われている。 心臓のようなより複雑な臓器では、心臓弁のようなより小さな構造物もまた研究の対象となっている。 いくつかの印刷された臓器は、臨床的実施のための機能要件に近づきつつあり、主に膀胱などの中空構造ならびに尿管などの血管構造を含む。
3D印刷は、細胞足場を形成する特定の臓器構造の層ごとの構築を可能にする。 これに続いて、目的の細胞を足場構造上に直接ピペットで入れる細胞播種のプロセスを行うことができる。 さらに、その後に種蒔きを行う代わりに、細胞を印刷可能な材料自体に組み込むプロセスが探求されている。
修正されたインクジェットプリンタは、三次元の生物学的組織を生成するために使用されてきた。 プリンターカートリッジは、生細胞の懸濁液とスマートゲルで満たされ、後者は構造を提供するために使用されます。 スマートゲルおよび生細胞の交互パターンは、標準的なプリントノズルを用いてプリントされ、最終的に細胞が融合して組織を形成する。 完了すると、ゲルは冷却され、洗い流され、生きた細胞だけが残る。
歴史
細胞構築物を作製するための3D印刷は、2003年に初めて導入された。 クレムソン 大学 細胞にインクジェットプリンティングを使用する特許を取得しました。 このプロセスは、基板上に配置された組織化された3Dマトリックスへの細胞の沈着のための修正されたスポッティングシステムを利用した。
Bolandの初期の発見以来、細胞構造とは対照的に、組織構造および器官構造の生成を包含するために、生物構造の3D印刷(バイオプリントとも呼ばれる)がさらに開発されてきた。 さらに、押出バイオプリントのような印刷のためのより多くの技術が研究され、その後製造手段として導入されている。
オルガン印刷は、ドナー機関の世界的な不足のための潜在的な解決策として近づいてきた。 臨床の場面で首尾よく印刷され、実施された器官は、皮膚のような平坦なもの、血管のような血管、または膀胱のような中空のものである。 人工器官が移植のために準備されるとき、人工器官はしばしば受取人自身の細胞で生産される。
より複雑な臓器、すなわち固体細胞構造からなる臓器が研究されている。 これらの器官には、心臓、膵臓、および腎臓が含まれる。 生存可能な医療処置としてそのような器官を導入することができる時期についての見積もりは様々である。 2013年、Organovo社は3Dバイオプリントを使用してヒト肝臓を作製しましたが、移植には適しておらず、主に薬物検査の媒体として使用されていました。
アプローチ
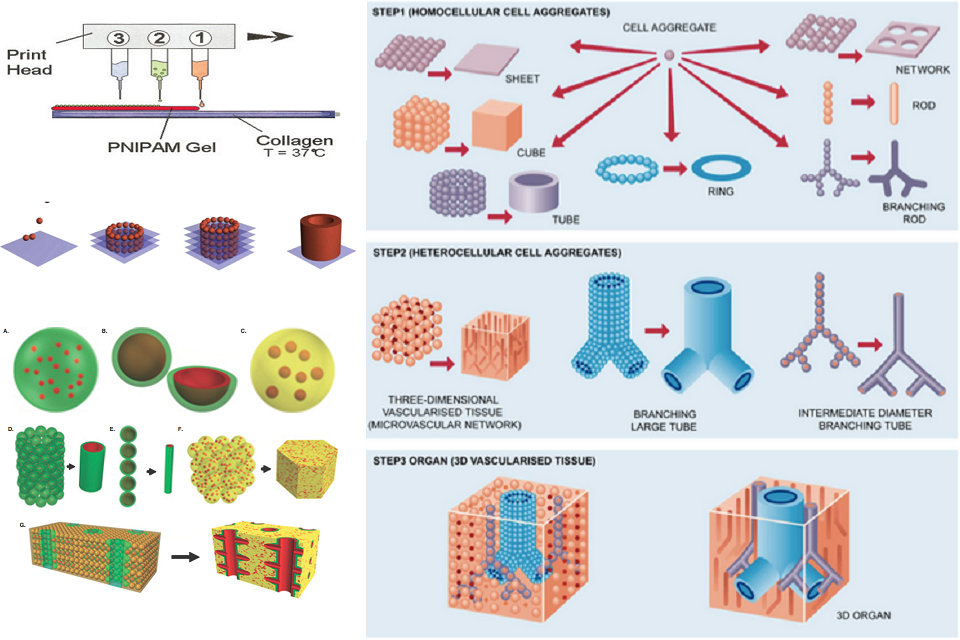
研究者は、生きた合成器官を製造するために異なるアプローチを開発してきた。 3Dバイオ印刷は、3つの主なアプローチに基づいています。生体模倣、自律的自己組織化、およびミニティッシュブロックの構築。
生体模倣
バイオ印刷への第1のアプローチは、バイオミメリリーと呼ばれる。 このアプローチの主な目的は、自然の構造と同じ構造を作成することです。 生体模倣は、器官および組織の形状、フレームおよび微小環境の重複を必要とする。 バイオ印刷におけるバイオミメリアプリケーションは、器官の細胞および細胞外部分の同一コピーを含む。 このアプローチが成功するためには、ミクロンスケールでの組織複製が必要である。 この程度の精度は、微小環境、生物学的力の性質、細胞の正確な構成、溶解度因子、および細胞外マトリックスの組成および構造を理解することを含む。
自己組織化
バイオ印刷に使用される第2のアプローチは、自律的自己組織化である。 このアプローチは、胚の器官を発達させる自然の物理的プロセスに依存する。 細胞が初期の発達段階にあるとき、それらは独自の細胞外マトリクス構築ブロックを作り、独自の細胞シグナリングを生成し、予想される生物学的機能を提供するために必要なレイアウトとマイクロアーキテクチャをとる。 自律的自己組織化は、胚における組織および器官の発達過程の知識を必要とする。 自律的自己組織化は、細胞の能力を組織形成の基本的なビルディングブロックとして利用します。 したがって、この技術は、組織が成長する微小環境と同様に、胚組織発達のメカニズムの非常に完全な理解を必要とする。
ミニファブリック
バイオ印刷に対する第3のアプローチは、生体模倣と自己組織化アプローチの両方の組み合わせである。 この技術は、「ミニティッシュ」と呼ばれています。 器官および組織は、非常に小さな機能的成分から作られる。 ミニファブリックのアプローチは、これらの小さなピースを取って、より大きな構造に配置することです。 このアプローチは、2つの異なる戦略を使用します。 第一の戦略は、自然な模様を目安にして、大規模な織物に自己組織化されたセル球を使用することです。 第2の戦略は、正確な複製物と高品質の織物を開発し、大規模な機能性織物に自動的に取り付けることができるようにすることです。 これらの戦略の混合は、複雑な三次元生物学的構造を印刷するために必要である。
オルガン印刷は、NBIC技術(ナノ、バイオ、情報、認知)が医学や外科手術を進め、時間を節約し、コストを削減し、患者や患者に新たな機会を創出する大きな可能性を秘めています。 健康専門家。
3D印刷技術
人工臓器の製造のための3D印刷は、生物工学における重要な研究課題であった。 3D印刷によってもたらされる迅速な製造技術がますます効率的になるにつれて、人工器官合成におけるそれらの適用性がより顕著になった。 3D印刷の主な利点のいくつかは、足場構造の大量生産能力、足場製品の高度な解剖学的精度にあります。 これにより、より効果的に天然器官または組織構造の微細構造に似ている構築物の作成が可能になる。
3D印刷を用いた器官印刷は、様々な技法を用いて実施することができ、それぞれが特定の種類の器官生産に適した特定の利点を与える。 オルガン印刷の最も顕著なタイプの2つは、ドロップベースのバイオプリントと押出バイオプリントです。 他にも多くのものが存在しますが、一般的に使われていないものや開発中です。
ドロップベースのバイオプリント(インクジェット)
ドロップベースのバイオプリントは、しばしば細胞株と組み合わされた、指定された材料の個々の液滴を用いて細胞構築物を作製する。 基板表面と接触すると、各液滴が重合し始め、個々の液滴が融合し始めるにつれてより大きな構造が形成される。 重合は基質上のカルシウムイオンの存在によって促進され、これは液化したバイオリンクに拡散し、固体ゲルの形成を可能にする。 ドロップベースのバイオプリントは、その効率的な速度のために一般的に使用されるが、この態様は、より複雑な臓器構造にはあまり適していない。
押し出しバイオプリント
押出バイオプリンティングは、特定の印刷材料およびセルラインを押出機(移動式プリントヘッドの一種)から一定の堆積させることを含む。 これは、材料または細胞沈着のためのより制御された、より穏やかなプロセスである傾向があり、3D組織または器官構造の構築においてより大きな細胞密度を使用することを可能にする。 しかしながら、このような利点は、この技術によってもたらされるより遅い印刷速度によって後退される。 押し出しバイオプリントは、しばしば、印刷された材料を光重合させて、より安定した一体構造を形成するUV光と結合される。
印刷材料
3D印刷のための材料は、通常、細胞の物理的付着を支持する細胞接着分子と一体化したアルギネートまたはフィブリンポリマーからなる。 そのようなポリマーは、構造安定性を維持し、細胞統合を受容するように特別に設計される。 用語「bioink」は、3Dバイオプリントと互換性のある材料の広範な分類として使用されてきた。
印刷材料は、広範囲の基準に適合しなければならず、最も重要なのは生体適合性である。 3D印刷物によって形成された足場は、物理的および化学的に細胞増殖に適切でなければならない。 生分解性はもう一つの重要な要素であり、人工的に形成された構造が、移植が成功すると分解され、完全に自然の細胞構造に置き換えられることを保証する。 3D印刷の性質上、使用される材料は、カスタマイズ可能であり、適応可能であり、幅広い種類の細胞型および構造的な立体配座に適していなければならない。
ヒドロゲルアルギン酸塩は、高度にカスタマイズ可能であり、天然の組織に特徴的なある機械的および生物学的特性をシミュレートするように微調整することができるので、器官印刷研究で最も一般的に使用される材料の1つとして浮上している。 特定のニーズに合わせて調整することができるヒドロゲルの能力は、種々の組織または臓器構造および生理学的状態に適した、適応可能な足場材料としてそれらを使用することを可能にする。 アルギン酸塩の使用における大きな課題は、その安定性および緩慢な分解であり、人工のゲル足場が分解され、移植された細胞自身の細胞外マトリックスと置換することを困難にする。 押出印刷に適したアルギン酸ヒドロゲルも、しばしば構造的にも機械的にも健全ではない。 しかし、この問題は、ナノセルロースのような他の生体高分子を取り込んでより大きな安定性を提供することによって媒介され得る。 アルギン酸塩または混合ポリマーバイオリンクの特性は調整可能であり、様々な用途および器官のタイプに対して変更することができる。
器官構造
オルガン印刷の技術課題の多くは、3Dバイオプリントの他のアプリケーションと共有されていますが、移植可能な印刷されたオルガンをうまく作成するためには、オルガン固有の構造要素があります。
血管新生
印刷臓器全体の細胞への栄養素と酸素の移動は、その機能にとって不可欠です。 厚さが1ミリメートル未満の非常に小さいまたは薄い組織では、細胞は拡散によって栄養分を受け取ることができる。 しかしながら、より大きな臓器は、組織の内部のより深い細胞への栄養素の輸送を必要とし、これは、組織を血管化し、酸素および細胞廃棄物のような貨物の交換のために血液を受け取ることを必要とする。 初期の臓器印刷技法は、宿主血管が移植に入ったときに血管新生ができないかまたは血管新生が遅れて組織の内部に壊死を起こし、健康を脅かす可能性がある組織を作り出した。 より最近開発された技術は、宿主循環系への移植のより速い統合を可能にする、既存の内部血管系を含む、より複雑な3D構造を有する印刷された器官を作製することを可能にする。 現在開発中の血管系を作製するための複数の技術がある。 1つの方法は、より大きな組織に組み込まれる血管の別個の押出印刷である。 もう1つの方法は、組織全体を一度に印刷し、溶解可能なまたは他の方法で取り除くことができるバイオリンクを使用して血管の内部を形成する犠牲印刷である。 この犠牲の足場が通常化学的または熱的方法によって除去されると、残りの組織は血管パターンを含む。
細胞供給源
完全な臓器の作成には、しばしば、別個のパターン化された方法で配置された様々な異なる細胞型の組み込みが必要である。 伝統的な移植と比較して、3Dプリントされた器官の1つの利点は、新しい器官を作製するために患者由来の細胞を使用する可能性である。 これは、移植拒絶の可能性を有意に減少させ、移植後の免疫抑制薬の必要性を除去し、移植の健康リスクを低下させる可能性がある。 しかし、必要な細胞型をすべて集めることは必ずしも可能ではない可能性があるため、採取した組織に成体幹細胞を採取するか多分化能を誘導する必要があります。 これは、人体外で発生し、成長因子の外部適用を必要とするため、資源集約的な細胞増殖および分化を含み、潜在的な健康リスクのセットを伴う。 しかしながら、いくつかの組織が分化した構造に自己組織化する能力は、組織を同時に構築し、異なる細胞集団を形成する方法を提供し、臓器印刷の有効性および機能性を改善する。