
人工細胞(Artificial cell)または最小細胞は、生物学的細胞の1つまたは複数の機能を模倣する操作された粒子である。 この用語は、特定の物理的実体を指すのではなく、生物学的細胞の特定の機能または構造が、合成実体で置換または補充され得るという考え方に関連する。 しばしば、人工細胞は、生物学的に活性な物質を包囲する生物学的または高分子的な膜である。 したがって、ナノ粒子、リポソーム、ポリマーソーム、マイクロカプセルおよび他の多くの粒子が人工細胞として認定されている。 マイクロカプセル化は、膜内の代謝、小分子の交換、およびそれを越える大きな物質の通過の防止を可能にする。 カプセル化の主な利点には、身体の改善された模倣、貨物の溶解度の増加、および免疫応答の低下が含まれる。 注目すべきことに、人工細胞は、血液灌流において臨床的に成功している。
合成生物学の分野では、「生きている」人工細胞は、エネルギーを捕捉し、イオン勾配を維持し、巨大分子を含み、情報を記憶し、突然変異させる能力を有する完全に合成された細胞として定義されている。 そのような細胞は技術的に実現可能ではないが、完全に合成されたゲノムがゲノム的に空にされた宿主細胞に導入された人工細胞のバリエーションが創出されている。 細胞質成分および宿主細胞からの膜が保持されるので完全には人工的ではないが、操作された細胞は合成ゲノムの制御下にあり、複製することができる。
歴史
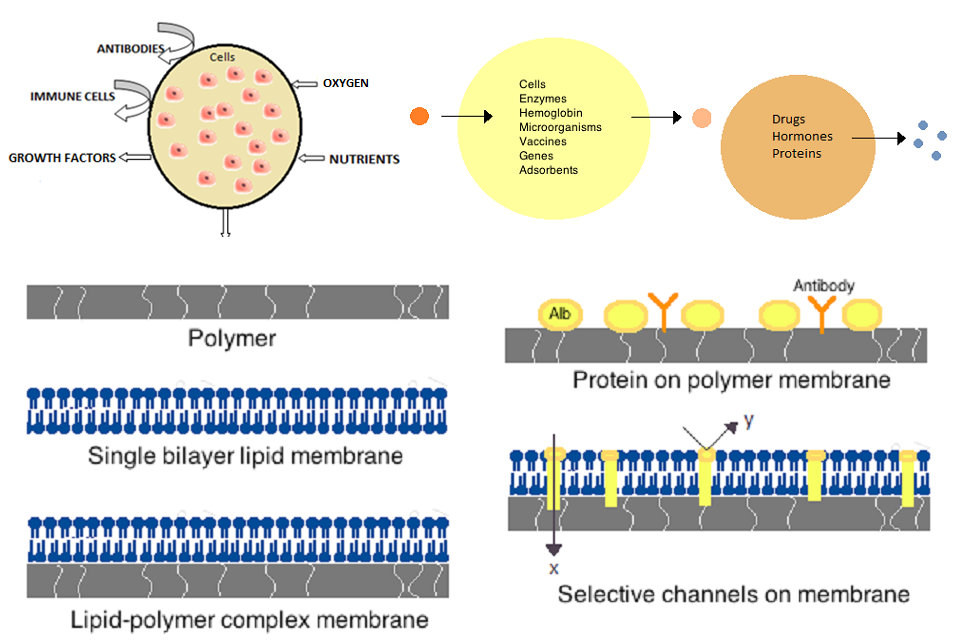
最初の人工細胞は、1960年代のMcGill UniversityのThomas Changによって開発されました。 これらの細胞は、ナイロン、コロジオンまたは架橋タンパク質の超薄膜から成り、その半透性が細胞の内外への小分子の拡散を可能にした。 これらの細胞はミクロンサイズであり、細胞、酵素、ヘモグロビン、磁性物質、吸着剤およびタンパク質を含有していた。
後の人工細胞は、100マイクロメートルからナノメートルの範囲の範囲にあり、微生物、ワクチン、遺伝子、薬物、ホルモンおよびペプチドを運ぶことができる。 人工細胞の最初の臨床的使用は、活性炭の封入による血液灌流であった。
1970年代、研究者は生分解性マイクロカプセルに酵素、タンパク質、ホルモンを導入し、後にレッシュ・ニャン症候群などの病気に臨床的に使用することができました。 Changの最初の研究は人工赤血球に焦点を絞ったが、1990年代半ばに生分解性人工赤血球が開発されただけである。 1994年に糖尿病患者の治療のために臨床細胞で人工細胞を最初に使用し、肝細胞、成体幹細胞、遺伝子組み換え細胞などの他のタイプの細胞が封入され、組織再生。
2011年12月29日、ハーバード大学の化学者は、人工細胞膜の作成を報告しました。
2014年までに、細胞壁および合成DNAを有する自己複製の合成細菌細胞が作製された。 その年の1月に、研究者は働くオルガネラを介して複数の化学反応を行うことができる人工真核細胞を作製した。
2018年9月、カリフォルニア大学の研究者らは、細菌を殺すことができる人工細胞を開発しました。 細胞はボトムアップ型のレゴブロックからバクテリアを破壊するように設計されました。
材料
人工細胞の膜は、単純なポリマー、架橋タンパク質、脂質膜またはポリマー – 脂質複合体で作られていなければならない。 さらに、膜は、アルブミン、抗原、Na / K-ATPase担体、またはイオンチャネルなどの細孔のような表面タンパク質を提示するように操作することができる。 メンブレンの製造に一般的に使用される材料には、アルギン酸塩、セルロースおよびヒドロキシエチルメタクリレート – メチルメタクリレート(HEMA-MMA)、ポリアクリロニトリル – ポリ塩化ビニル(PAN-PVC)などの熱可塑性ポリマーのようなヒドロゲルポリマー、と述べた。 使用される材料は、ポリマーについて、カットオフ分子量(MWCO)に依存する細胞膜の透過性を決定する。 MWCOは、細孔を自由に通過できる分子の最大分子量であり、栄養素、廃棄物および他の重要な分子の十分な拡散を決定する上で重要である。 親水性ポリマーは、生体適合性である可能性を有し、ポリマーミセル、ゾル – ゲル混合物、物理的ブレンドおよび架橋粒子およびナノ粒子を含む様々な形態に製造することができる。 特に重要なのは、標的送達での使用のためにpHまたは温度変化に応答する刺激応答性ポリマーである。 これらのポリマーは、巨視的注射によって液体形態で投与され、pHまたは温度の相違のためにその場で固化またはゲル化され得る。 ナノ粒子およびリポソーム調製物も、物質のカプセル化および送達のために日常的に使用される。 リポソームの主な利点は、細胞および細胞小器官膜に融合する能力である。
準備
人工細胞の調製およびカプセル化のための多くのバリエーションが開発されている。 典型的には、ナノ粒子、ポリマーソームまたはリポソームのような小胞が合成される。 エマルジョンは、典型的には、高圧ホモジナイザーまたはマイクロフルイダイザーなどの高圧装置の使用によって製造される。 ニトロセルロースの2つのマイクロカプセル化方法も以下に記載する。
高圧均質化
高圧ホモジナイザーでは、油/液体懸濁液中の2つの液体が、非常に高圧の小さなオリフィスを通って押し出される。 このプロセスは、製品を分割し、1nm程度の極めて微細な粒子の生成を可能にする。
マイクロ流動化
この技術は、特許を取得したMicrofluidizerを使用して、ホモジナイザーよりも小さな粒子を作り出すことができる均質な懸濁液のより多くの量を得る。 ホモジナイザーを最初に使用して、粗い懸濁液を生成し、次いでそれを高圧下でマイクロフルイダイザーにポンプで送る。 次いで、流れを2つの流れに分割し、所望の粒度が得られるまで相互作用チャンバ内で非常に高い速度で反応する。 この技術は、リン脂質リポソームの大量生産およびその後の材料ナノカプセル化を可能にする。
ドロップメソッド
この方法では、細胞溶液を硝酸セルロースのコロジオン溶液に滴下する。 液滴がコロジオンを通過する際、コロジオンの界面重合特性のために液滴が膜でコーティングされる。 細胞は後にパラフィンに沈降し、そこで膜が硬化し、最後に生理食塩水が懸濁される。 ドロップ法は、生物学的細胞、幹細胞、および遺伝子操作された幹細胞をカプセル化する大きな人工細胞の作成に使用されます。
エマルジョン法
エマルジョン法は、カプセル化される物質が通常より小さく、反応チャンバの底部に配置され、そこでコロジオンが上に加えられ、遠心分離されるか、さもなければエマルジョンを生成するために乱されるという点で異なる。 カプセル化された材料は、次いで、生理食塩水に分散され、懸濁される。
臨床的関連性
薬物放出および送達
薬物送達に使用される人工細胞は、それらの内容物が膜から拡散することが意図されているか、または宿主標的細胞によって包み込まれ、消化されるため、他の人工細胞とは異なる。 しばしば、ナノカプセル、ナノ粒子、ポリマーソーム、またはこの用語の他の変形と呼ばれ得る、サブミクロンの脂質膜人工細胞が使用される。
酵素療法
酵素治療は、酵素が過剰発現、過少発現、欠陥、または全く存在しない遺伝的代謝疾患について積極的に研究されている。 不完全な発現または欠損酵素の発現の場合、欠損を補うために、酵素の活性型が体内に導入される。 一方、酵素の過剰発現は、競合する非機能的酵素の導入によって中和され得る。 すなわち、基質を非活性生成物に代謝する酵素である。 人工細胞内に置かれた場合、酵素は遊離酵素と比較してはるかに長い期間それらの機能を果たすことができ、ポリマーコンジュゲーションによってさらに最適化することができる。
人工細胞封入下で研究された最初の酵素は、マウスのリンパ肉腫の治療のためのアスパラギナーゼであった。 この治療は、腫瘍の発症および成長を遅延させた。 これらの最初の知見は、チロシン依存性メラノーマにおける酵素送達のための人工細胞の使用におけるさらなる研究を導いた。 これらの腫瘍は、増殖のために正常細胞よりもチロシン依存性が高く、マウスのチロシンの全身レベルを低下させるとメラノーマの増殖を阻害できることが研究によって示されている。 チロシナーゼの送達における人工細胞の使用; チロシンを消化する酵素は、より良好な酵素安定性を可能にし、食事中のチロシン鬱病に伴う重篤な副作用なしにチロシンの除去に有効であることが示される。
人工細胞酵素療法は、ある種の癌において、イホスファミドなどのプロドラッグの活性化にも関心がもたれている。 このプロドラッグを活性薬物に変換するシトクロムp450酵素を封入した人工細胞は、膵臓癌に蓄積するか、または腫瘍部位に近い人工細胞を移植するように調整することができる。 ここで、活性化されたイホスファミドの局所濃度は体の残りの部分よりもはるかに高く、したがって全身毒性を防止する。 治療は動物で成功し、第I相/ II相臨床試験で進行期の膵がん患者の生存期間中央値が倍増し、1年生存率が3倍になった。
遺伝子治療
遺伝病の治療において、遺伝子治療は、罹患した個体の細胞内の遺伝子の挿入、変更または除去を目的とする。 この技術は、ヒトの死亡および臨床試験における白血病の発症につながった挿入変異誘発および全身性免疫応答に対する懸念を引き起こすウイルスベクターに大きく依存している。 裸のDNAまたはプラスミドDNAをそれ自体の送達系として用いることによるベクターの必要性を回避することは、全身的に与えられた場合、形質導入効率が低く、組織ターゲティングが劣るなどの問題にも遭遇する。
人工細胞は、遺伝子改変された非自己細胞を封入してインビボで組換えタンパク質を送達するために移植する非ウイルスベクターとして提案されている。 このタイプの免疫単離は、変異マウスにおいて成長遅延を救済したマウス成長ホルモンを含有する人工細胞の送達によってマウスにおいて効率的であることが証明されている。 膵臓癌、側索硬化症および疼痛制御のためのいくつかの戦略がヒト臨床試験に移行している。
髄腔流
人工細胞の最初の臨床的使用は、活性炭の封入による血液灌流であった。 活性炭は、多くの大きな分子を吸着する能力を有し、偶発的な中毒または過剰摂取の際に血液から毒性物質を除去する能力に関して長年知られてきた。 しかし、直接的な炭投与による灌流は、塞栓症および血液細胞の損傷に続いて血小板による除去をもたらすので、毒性がある。 人工細胞は毒素を細胞に拡散させ、危険な貨物を極薄の膜内に保ちます。
人工細胞の血液灌流は、血液濾過が物理的膜によるサイズ分離のみによって行われる血液透析よりも費用がかからず、より効率的な解毒の選択肢として提案されている。 血液灌流では、患者の血液が灌流する両端の2つのスクリーンを使用して、何千もの吸着性人工細胞が小さな容器の内部に保持されます。 血液が循環するにつれて、毒素または薬剤が細胞内に拡散し、吸収材料によって保持される。 人工細胞の膜は、透析に使用されるものよりもはるかに薄く、その小さいサイズは、それらが高い膜表面積を有することを意味する。 これは、細胞の一部が、人工腎臓機械全体の100倍高い理論上の物質移動を有することができることを意味する。 この装置は、偶然または自殺のための治療を受けている患者のための日常的な臨床方法として確立されているが、これらの器官の機能の一部を実行することによって肝不全および腎不全の治療としても導入されている。 アルブミンのような免疫吸着物質を人工細胞の表面に付着させることによって抗体を身体から除去することができる免疫吸着に使用する人工細胞血液灌流も提案されている。 この原理は、低密度リポタンパク質を除去するモノクローナル抗体による骨髄移植および高コレステロール血症の治療のための血漿由来の血液型抗体を除去するために使用されてきた。 血液浄化は、血液透析製造産業が弱い国では、装置がより安価で腎不全患者に使用される傾向があるため、特に有用である。
カプセル化された細胞
人工細胞の調製の最も一般的な方法は、細胞のカプセル化によるものである。 カプセル化された細胞は、典型的には、液体細胞懸濁液からの制御されたサイズの液滴の生成によって達成され、その後急速に固化またはゲル化して安定性を増強する。 安定化は、温度の変化または材料の架橋を介して達成することができる。 カプセル化の際に細胞が変化する微小環境。 それは、典型的には、単分子膜上から高分子膜内のポリマー骨格中の懸濁液に移行する。 この技術の欠点は、細胞をカプセル化することは、その生存能力および増殖能力および分化能力を低下させることである。 さらに、マイクロカプセル内のしばらくした後、細胞は、酸素および代謝廃棄物の交換を阻害するクラスターを形成し、アポトーシスおよび壊死をもたらし、したがって、細胞の有効性を制限し、宿主の免疫系を活性化する。 人工細胞は、糖尿病治療のためのランゲルハンス島、副甲状腺細胞および副腎皮質細胞を含む多くの細胞を移植するのに成功している。
カプセル化肝細胞
臓器提供者の不足は、人工細胞を肝不全の代替治療法のキープレーヤーにしている。 肝細胞移植のための人工細胞の使用は、動物の肝臓疾患およびバイオ人工肝臓装置のモデルにおいて肝機能を提供する上での実行可能性および有効性を実証している。 研究は、肝細胞をマイクロキャリアの表面に付着させ、ポリリシンの外皮によって覆われたアルギン酸微小液滴中の三次元マトリックス中に封入された肝細胞に進化した実験を止めた。 この送達方法の主な利点は、治療期間中の免疫抑制療法の回避である。 肝実質細胞のカプセル化は、生物学的肝臓での使用が提案されている。 この装置は、分離された肝細胞が埋め込まれた円筒形のチャンバーから成り、患者の血漿は、血液灌流の一種で体外循環する。 マイクロカプセルは、体積に対する表面積比が高いため、基質拡散のために大きな表面を提供し、多数の肝細胞に適応することができる。 誘導された肝不全マウスに対する治療は、生存率の有意な増加を示した。 人工肝臓システムはまだ早期に開発されているが、臓器移植を待つ患者や、患者自身の肝臓が正常な機能を回復するために十分に再生する間、潜在的可能性を示す。 これまで、人工肝臓システムを用いた臨床試験および末期肝疾患における肝細胞移植は、健康マーカーの改善を示したが、生存率を改善していない。 短期間での移植後の人工肝細胞の寿命および凝集は、遭遇する主な障害である。 幹細胞と同時カプセル化された肝細胞は、培養においてより大きな生存率を示し、移植後および人工幹細胞の移植だけでも肝再生を示した。 そのような関心は、再生医療におけるカプセル化のための幹細胞の使用において生じている。
カプセル化された細菌細胞
生きた細菌細胞コロニーの経口摂取が提案されており、現在、腸内微生物叢の調節、下痢症の予防、H.ピロリ感染症の治療、アトピー性炎症、乳糖不耐症および免疫調節などの治療に用いられている。 提案された作用メカニズムは完全には理解されていないが、2つの主な効果を有すると考えられている。 第1は、細菌が毒素産生細菌と競合する栄養効果である。 第2は衛生的効果であり、植民地への抵抗を刺激し、免疫応答を刺激する。 細菌培養物の経口送達は、免疫系の標的となり、経口摂取の際にしばしば破壊されるので、しばしば問題となる。 人工細胞は、身体に模倣を提供し、選択的または長期的放出を提供することにより、消化器系に到達する細菌の生存率を高めることによって、これらの問題に対処するのを助ける。 さらに、生細菌細胞のカプセル化は、ペプチドを含む小分子の治療目的のための身体への拡散を可能にするように操作することができる。 細菌送達に成功した膜は、セルロースアセテートおよびアルギネートの変異体を含む。 細菌細胞のカプセル化からのアロセンを有するさらなる用途には、結核菌(M.Tuberculosis)からの攻撃および免疫系からのIg分泌細胞のアップレギュレーションが含まれる。 この技術は、全身感染、代謝活動の有害性、遺伝子移入のリスクのリスクによって制限されています。 しかしながら、より大きな挑戦は、関心のある部位への十分な生存細菌の送達のままである。
人工血液細胞
酸素キャリア
ナノサイズの酸素運搬体は、赤血球代替物の一種として使用されるが、赤血球の他の成分を欠いている。 それらは、精製された動物、ヒトまたは組換えヘモグロビンを取り囲む合成ポリマーソームまたは人工膜からなる。 全体として、ヘモグロビン送達は、何の変更もなしに送達されると非常に有毒であるため、依然として課題である。 いくつかの臨床試験では、第1世代のヘモグロビン代用血液について、昇圧効果が観察されています。
赤血球
1980年代のAIDSの恐怖の後に、人工細胞を血液に使用するという研究の関心が高まった。 病気の伝達の可能性を迂回すること以外に、人型赤血球は、血液型検査、免疫反応および42日間の短い貯蔵寿命などの同種の輸血に関連する欠点を排除するので望ましい。 ヘモグロビン代替物は、冷凍下ではなく室温で、1年以上保存することができる。 酸素担体だけでなく、細胞に関連する酵素も含む炭素を含む完全な作用赤血球を開発する試みがなされている。 最初の試みは、赤血球膜を超薄型ポリマー膜で置き換え、続いて脂質膜を介してカプセル化し、より最近では生分解性ポリマー膜で置換することによって、1957年になされた。 脂質および関連タンパク質を含む生物学的赤血球膜もまた、マクロファージの取り込みおよび全身クリアランスを回避することによって、ナノ粒子をカプセル化し、インビボでの滞留時間を増加させるために使用され得る。
ロイコポリマーソーム
ロイコポリマーソームは、白血球の接着特性を有するように設計されたポリマーソームである。 ポリマーソームは、薬物または酵素などの多くの活性分子をカプセル化することができる二重層シートからなる小胞である。 白血球の接着特性をそれらの膜に加えることにより、それらは急速に流れる循環系内の上皮壁を減速させるか、またはそれに沿って回転させることができる。
合成細胞
最小細胞
ドイツ病理学者Rudolf Virchowは、細胞から生命が生じるだけでなく、すべての細胞が別の細胞から来るという考えをもたらしました。 「オムニス・セルラ・セルラ」。 今まで、人工細胞を作成しようとするほとんどの試みは、細胞の特定のタスクを真似ることができるパッケージを作成したにすぎません。 無細胞転写および翻訳反応の進歩は多くの遺伝子の発現を可能にするが、これらの努力は完全に作動可能な細胞を産生することには程遠い。
将来は、プロトコセル、または生命のための最小限の要件をすべて満たすセルの作成にあります。 J. Craig Venter Instituteのメンバーは、生きた生物の遺伝子を最小限の遺伝子セットにノックアウトするためのトップダウンの計算手法を使用しています。 2010年には、遺伝子的に空のバクテリアに挿入された生命の最小必要条件と考えられる合成DNAを用いて、Mycoplasma mycoides(Mycoplasma laboratorium)の複製株を作製することに成功しました。 トップダウン生合成のプロセスは、燃料として水素の生成や大気中の過剰な二酸化炭素の捕捉などの有益な機能を果たす新しい遺伝子の挿入を可能にすることが期待されている。 無数の規制、代謝、およびシグナル伝達ネットワークは完全に特徴付けられていません。 これらのトップダウンアプローチは、宿主生物が複雑で不完全に定義された分子組成を有するため、基本的な分子制御の理解には限界がある。
人工細胞を構築するためのボトムアップアプローチは、完全に非生物材料からプロトセルを新規に作成することを含む。 合成遺伝子情報を用いて自己複製可能なDNAを有するリン脂質二重層小胞を作製することが提案されている。 そのような人工細胞の3つの主要な要素は、脂質膜の形成、鋳型プロセスによるDNAおよびRNA複製、および膜を横切る能動輸送のための化学エネルギーの収穫である。 このプロトコセルで予見され、遭遇する主なハードルは、人生に必要なすべての情報を保持する最小限の合成DNAの創造、分子自己組織化などの細胞発生に不可欠な非遺伝的構成要素の複製である。 しかし、このようなボトムアップアプローチは、細胞レベルでの組織の基本的な問題や生物学的生命の起源についての洞察を提供することが期待されています。 これまで人生の分子を使って自己再生可能な人工細胞は完全に合成されておらず、この目標は現在も様々なグループがこの目標に向けて努力していますが、まだ遠い将来です。
プロトセルを作成するために提案された別の方法は、原始スープとして知られている進化中に存在していたと考えられる条件に一層密接に似ている。 種々のRNAポリマーを小胞に封入することができ、そのような小さな境界条件で化学反応を試験する。
生物学への多額の投資は、Synthetic Genomics Incと提携しているExxonMobilなどの大企業によって行われました。 藻類からの燃料の開発におけるCraig Venter自身の生合成系会社。
電子人工細胞
電子人工細胞の概念は、2004年から2015年まで、John McCaskillによって調整された一連の3つのEUプロジェクトで拡大されました。
欧州委員会は、2004〜2008年の「プログラマブル人工細胞進化(Programmable Artificial Cell Evolution:PACE)」プログラムの開発を支援した。その目的は、「シンプルなものから構築された微視的自己組織化自己複製および進化自律エンティティ情報システムへの最終的な統合のために「特定の機能を実行するように遺伝的にプログラムすることができる有機および無機物質」である。 PACEプロジェクトは、ノーマン・パッカード、Steen Rasmussen、Mark Beadau、John McCaskillが最初に提案した化学的に欠けている機能を補完する人工細胞のためのマイクロ流体生活支援システムである最初のOmega Machineを開発しました。 究極の目的は、複雑なマイクロスケールのプログラマブル環境で進化型ハイブリッドセルを達成することでした。 その後、オメガ機械の機能を段階的に取り除くことができ、一連の解決可能な進化の課題が人工細胞化学にもたらされる可能性があります。 このプロジェクトは、人工細胞(遺伝的サブシステム、封じ込めシステムおよび代謝システム)の3つのコア機能の対のレベルまでの化学的統合を達成し、封じ込めと遺伝子増幅の統合のための空間的に解決されたプログラム可能なマイクロ流体環境を創出した。 「プログラム可能な人工細胞の進化」(PACE)このプロジェクトは、現在も同様の研究を続けているヨーロッパの生存技術センターの創設につながった。
この研究の後、2007年にJohn McCaskillは電子化学セルと呼ばれる電子的に補完された人工細胞に集中することを提案した。 重要なアイデアは、出現する化学的細胞機能性を補完するために、局所的に専用の電子回路に結合された電極の大規模並列アレイを二次元薄膜で使用することでした。 電極スイッチングおよび検出回路を規定する局所的な電子情報は、新しいゲノムとして機能し、出現するプロトコルにおける分子逐次情報を補完することができる。 欧州委員会での研究提案が成功し、PACEコンソーシアムと一部重複している国際的な科学者チームが、2008-2012プロジェクトを電子化学セルプロジェクトで開始しました。 このプロジェクトは、特定の配列の電子的に制御された局所輸送が、将来の人工細胞の遺伝的増殖のための人工的な空間制御システムとして使用でき、代謝の中核プロセスが適切に被覆された電極アレイによって送達され得ることを実証した。
このアプローチの主な制限は、マイクロスケールの電気化学および電気力学を習得する上での初期の困難さを除けば、電子システムが巨視的なハードウェアの非自律的で剛性のない部分として相互接続されていることである。 2011年、McCaskillは、化学物質をアクティブな電子媒体に配置する代わりに、微視的な自律型エレクトロニクスを化学媒体に配置する代わりに、エレクトロニクスと化学のジオメトリを逆転させることを提案しました。 彼は、内部の化学空間を封入する2つの半セル「lablets」から自己集合し、媒体によって駆動される能動的なエレクトロニクスの助けを借りて機能する、100μmスケールの第3世代の電子人工細胞に取り組むプロジェクトを組織したそのような細胞は、それらの電子的および化学的内容の両方をコピーすることができ、特別に予め合成された微視的な構成単位によって提供される制約内で進化することができる。 2012年9月に、このプロジェクトでMicroscale Chemically Reactive Electronic Agentsが開始されました。
倫理と論争
Protocellの研究は、 “人工生命”の漠然とした定義の批評家を含む論争と反対意見を作り出しました。 基本的な生活の単位は、最も倫理的な関心事ですが、プロトコセルについての最も広範な心配は、制御されていない複製を通じて人間の健康と環境への潜在的な脅威です。