Un organo stampabile è un dispositivo costruito artificialmente progettato per la sostituzione di organi, prodotto utilizzando tecniche di stampa 3D. Il principale scopo degli organi stampabili è il trapianto. La ricerca è attualmente in corso su strutture artificiali di cuore, reni e fegato, nonché su altri organi importanti. Per gli organi più complicati, come il cuore, anche i costrutti più piccoli come le valvole cardiache sono stati oggetto di ricerca. Alcuni organi stampati si avvicinano ai requisiti di funzionalità per l’implementazione clinica e includono principalmente strutture cave come la vescica, nonché strutture vascolari come i tubi delle urine.
La stampa 3D consente la costruzione strato per strato di una particolare struttura d’organo per formare uno scaffold cellulare. Questo può essere seguito dal processo di semina cellulare, in cui le cellule di interesse vengono pipettate direttamente sulla struttura dello scaffold. Inoltre, è stato esplorato il processo di integrazione delle celle nel materiale stampabile stesso, invece di eseguire la semina in un secondo momento.
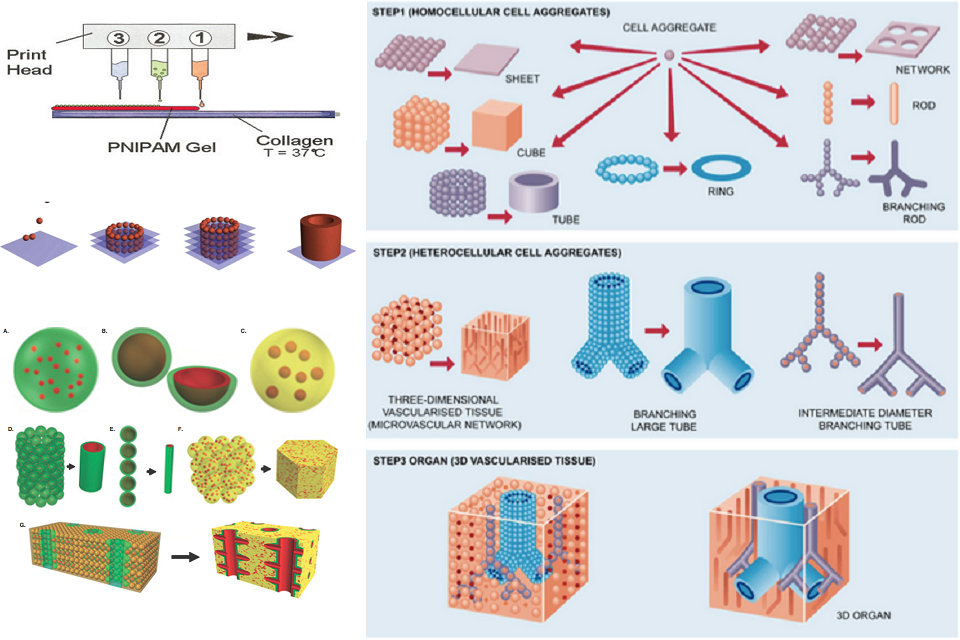
Stampanti a getto d’inchiostro modificate sono state utilizzate per produrre tessuto biologico tridimensionale. Le cartucce della stampante sono riempite con una sospensione di cellule viventi e un gel intelligente, quest’ultimo utilizzato per fornire la struttura. I modelli alternati del gel intelligente e delle cellule viventi vengono stampati utilizzando un ugello di stampa standard, con le cellule che alla fine si fondono insieme per formare il tessuto. Una volta completato, il gel viene raffreddato e lavato via, lasciando solo le cellule vive.
Storia
La stampa 3D per produrre un costrutto cellulare fu introdotta per la prima volta nel 2003, quando Thomas Boland della Clemson University brevettò l’uso della stampa a getto d’inchiostro per le celle. Questo processo utilizzava un sistema di smacchiatura modificato per la deposizione di cellule in matrici 3D organizzate posizionate su un substrato.
Sin dalle prime scoperte di Boland, la stampa 3D di strutture biologiche, nota anche come bioprinting, è stata ulteriormente sviluppata per comprendere la produzione di strutture di tessuti e organi, al contrario delle matrici cellulari. Inoltre, sono state studiate e successivamente introdotte come mezzo di produzione più tecniche di stampa, come la biostampa per estrusione.
La stampa di organi è stata contattata come una potenziale soluzione per la carenza globale di organi dei donatori. Gli organi che sono stati stampati e implementati con successo in un ambiente clinico sono piatti, come la pelle, vascolare, come i vasi sanguigni, o la cavità, come la vescica. Quando gli organi artificiali sono preparati per il trapianto, vengono spesso prodotti con le cellule del ricevente.
Gli organi più complessi, cioè quelli che consistono in solide strutture cellulari, sono sottoposti a ricerca; questi organi includono il cuore, il pancreas e i reni. Le stime per quando tali organi possono essere introdotti come un trattamento medico praticabile variano. Nel 2013, la società Organovo ha prodotto un fegato umano utilizzando il bioprinting 3D, sebbene non sia adatto per il trapianto, ed è stato principalmente usato come mezzo per i test anti-droga.
approcci
I ricercatori hanno sviluppato diversi approcci per produrre organi sintetici viventi. La bio-stampa 3D si basa su tre approcci principali: biomimetica, auto-assemblaggio autonomo e costruzione di mini blocchi di tessuto.
biomimicry
Il primo approccio alla bio-stampa è chiamato biomimetica. L’obiettivo principale di questo approccio è creare strutture identiche alle strutture naturali. La biomimetica richiede la duplicazione della forma, della struttura e del microambiente di organi e tessuti. L’applicazione biomimetica nella bio-stampa comporta la copia identica delle parti cellulari ed extracellulari degli organi. Affinché questo approccio abbia successo, è necessaria la replicazione dei tessuti su una scala micrometrica. Questo grado di precisione implica la comprensione del microambiente, la natura delle forze biologiche, l’esatta organizzazione delle cellule, i fattori di solubilità e la composizione e la struttura della matrice extracellulare.
Autoassemblaggio
Il secondo approccio utilizzato nella bio-stampa è l’auto-assemblaggio autonomo. Questo approccio si basa sul naturale processo fisico di sviluppo degli organi embrionali. Quando le cellule sono nella fase iniziale di sviluppo, creano il proprio blocco di matrice extracellulare e producono la propria segnalazione cellulare e prendono il layout e la microarchitettura richiesti per fornire le funzioni biologiche previste. L’autoassemblaggio autonomo richiede la conoscenza dei processi di sviluppo di tessuti e organi nell’embrione. L’autoassemblaggio autonomo si basa sulle capacità delle cellule come elemento fondamentale dell’istogenesi. Questa tecnica richiede quindi una comprensione molto approfondita dei meccanismi dello sviluppo del tessuto embrionale e dei micro-ambienti in cui i tessuti crescono.
Mini-tessuto
Il terzo approccio alla bio-stampa è una combinazione di approcci biomimetici e di autoassemblaggio. Questa tecnica è indicata come “mini-tessuti”. Organi e tessuti sono fatti da componenti funzionali molto piccoli. L’approccio mini-tessuto consiste nel prendere questi piccoli pezzi e sistemarli in una struttura più grande. Questo approccio utilizza due diverse strategie. La prima strategia consiste nell’utilizzare sfere cellulari autoassemblate in tessuti su larga scala, utilizzando come guida modelli naturali. La seconda strategia è quella di sviluppare riproduzioni accurate e alta qualità del tessuto e consentirne il montaggio automatico su grandi tessuti funzionali su scala. La combinazione di queste strategie è necessaria per stampare una complessa struttura biologica tridimensionale.
La stampa di organi ha un grande potenziale per le tecnologie NBIC (nano, bio, informazioni e cognitive) per promuovere la medicina e le procedure chirurgiche, per risparmiare tempo, ridurre i costi e creare nuove opportunità per pazienti e pazienti. esperti della salute.
Tecniche di stampa 3D
La stampa 3D per la produzione di organi artificiali è stata uno dei principali argomenti di studio nell’ingegneria biologica. Dato che le tecniche di produzione rapida implicate dalla stampa 3D diventano sempre più efficienti, la loro applicabilità nella sintesi di organi artificiali è diventata più evidente. Alcuni dei principali vantaggi della stampa 3D risiedono nella sua capacità di produrre scaffold in serie e nell’alto grado di precisione anatomica dei prodotti di scaffold. Ciò consente la creazione di costrutti che assomigliano più efficacemente alla microstruttura di un organo naturale o di una struttura tissutale.
La stampa di organi utilizzando la stampa 3D può essere condotta utilizzando una varietà di tecniche, ognuna delle quali conferisce vantaggi specifici che possono essere adatti a particolari tipi di produzione di organi. Due dei più importanti tipi di stampa di organi sono la bioprinting a goccia e la bioprinting per estrusione. Esistono molti altri, anche se non sono così comunemente usati, o sono ancora in fase di sviluppo.
Bioprinting a goccia (getto d’inchiostro)
Il bioprinting a goccia crea costrutti cellulari usando singole goccioline di un materiale designato, che è stato spesso combinato con una linea cellulare. A contatto con la superficie del substrato, ogni goccia inizia a polimerizzare, formando una struttura più grande quando le singole goccioline iniziano a coalizzarsi. La polimerizzazione è istigata dalla presenza di ioni calcio sul substrato, che si diffondono nel bioink liquefatto e consentono la formazione di un gel solido. Il bioprinting a goccia è comunemente usato per la sua velocità efficiente, anche se questo aspetto lo rende meno adatto per strutture di organi più complicate.
Estrusione bioprinting
La biostampa con estrusione comporta la deposizione costante di un particolare materiale di stampa e una linea cellulare da un estrusore, un tipo di testina di stampa mobile. Questo tende ad essere un processo più controllato e delicato per la deposizione di materiale o di cellule, e consente di utilizzare densità cellulari maggiori nella costruzione di strutture 3D di organi o tessuti. Tuttavia, tali benefici sono rallentati dalle più lente velocità di stampa implicate da questa tecnica. La bioprinting dell’estrusione è spesso accoppiata con la luce UV, che fotopolimerizza il materiale stampato per formare un costrutto più stabile e integrato.
Materiali di stampa
I materiali per la stampa 3D di solito consistono in alginati o polimeri di fibrina che sono stati integrati con molecole di adesione cellulare, che supportano l’attaccamento fisico delle cellule. Tali polimeri sono specificamente progettati per mantenere la stabilità strutturale ed essere ricettivi all’integrazione cellulare. Il termine “bioink” è stato utilizzato come un’ampia classificazione di materiali compatibili con il bioprinting 3D.
I materiali di stampa devono soddisfare un ampio spettro di criteri, uno dei primi è la biocompatibilità. Gli scaffold risultanti formati da materiali stampati in 3D dovrebbero essere fisicamente e chimicamente appropriati per la proliferazione cellulare. La biodegradabilità è un altro fattore importante e assicura che la struttura formata artificialmente possa essere scomposta dopo il trapianto di successo, per essere sostituita da una struttura cellulare completamente naturale. A causa della natura della stampa 3D, i materiali utilizzati devono essere personalizzabili e adattabili, essendo adatti a un’ampia gamma di tipi di celle e conformazioni strutturali.
Gli alginati di idrogel sono emersi come uno dei materiali più comunemente utilizzati nella ricerca sulla stampa di organi, in quanto sono altamente personalizzabili e possono essere messi a punto per simulare determinate proprietà meccaniche e biologiche caratteristiche del tessuto naturale. La capacità degli idrogel di adattarsi a esigenze specifiche consente loro di essere utilizzati come materiale di scaffold adattabile, adatto per una varietà di strutture di tessuti o organi e condizioni fisiologiche. Una delle principali sfide nell’uso dell’alginato è la sua stabilità e la sua lenta degradazione, che rende difficile la disgregazione degli scaffold artificiali e la loro sostituzione con la matrice extracellulare delle cellule impiantate. Anche l’idrogel di alginato adatto alla stampa per estrusione è spesso meno strutturalmente e meccanicamente sano; tuttavia, questo problema può essere mediato dall’incorporazione di altri biopolimeri, come la nanocellulosa, per fornire una maggiore stabilità. Le proprietà del bioink alginato o polimero misto sono regolabili e possono essere modificate per diverse applicazioni e tipi di organi.
Strutture di organi
Mentre molte delle sfide tecniche della stampa di organi sono condivise con altre applicazioni del bioprinting 3D, ci sono alcuni elementi strutturali specifici per organo che devono essere affrontati per la creazione di successo di un organo stampato trapiantabile.
vascolarizzazione
Il trasferimento di nutrienti e ossigeno alle cellule attraverso un organo stampato è essenziale per la sua funzione. In tessuti molto piccoli o sottili di spessore inferiore a un millimetro, le cellule possono ricevere nutrienti attraverso la diffusione. Tuttavia, gli organi più grandi richiedono il trasporto di sostanze nutritive alle cellule più profonde all’interno del tessuto, il che richiede che il tessuto sia vascolarizzato e quindi in grado di ricevere sangue per lo scambio di carichi come l’ossigeno e i rifiuti cellulari. Le prime tecniche di stampa di organi hanno creato tessuti solidi che non erano in grado di vascolarizzare, o vascolarizzati solo lentamente come vasi sanguigni ospiti nel trapianto, portando a problemi come la necrosi all’interno del tessuto che possono minacciare la salute e il recupero di successo di un trapiantato. Tecniche più recenti sviluppate consentono di creare organi stampati con una struttura 3D più complessa, compresa la vascolarizzazione interna preesistente, che consente una più rapida integrazione del trapianto nel sistema circolatorio ospite. Esistono diverse tecniche per la creazione di sistemi vascolari attualmente in fase di sviluppo. Un metodo è la stampa di estrusione separata di vasi che vengono quindi incorporati in un tessuto più grande. Un altro metodo è la stampa sacrificale, in cui viene stampato l’intero tessuto in una volta, e un bioink dissolvibile o altrimenti rimovibile viene utilizzato per formare l’interno dei vasi. Una volta rimosso questo ponteggio sacrificale, di solito con un metodo chimico o termico, il resto del tessuto contiene quindi un modello vascolare.
Fonti di cellule
La creazione di un organo completo spesso richiede l’incorporazione di una varietà di diversi tipi di cellule, disposti in modi distinti e modellati. Un vantaggio degli organi stampati in 3D, rispetto ai trapianti tradizionali, è la possibilità di utilizzare cellule derivate dal paziente per creare il nuovo organo. Questo riduce significativamente la probabilità di rigetto del trapianto e può rimuovere la necessità di farmaci immunosoppressori dopo il trapianto, che ridurrebbe i rischi per la salute dei trapianti. Tuttavia, poiché potrebbe non essere sempre possibile raccogliere tutti i tipi cellulari necessari, potrebbe essere necessario raccogliere cellule staminali adulte o indurre pluripotenza nel tessuto raccolto. Ciò comporta una crescita e una differenziazione delle cellule a uso intensivo di risorse e comporta una serie di potenziali rischi per la salute, poiché la proliferazione cellulare in un organo stampato avviene al di fuori del corpo e richiede l’applicazione esterna di fattori di crescita. Tuttavia, la capacità di alcuni tessuti di auto-organizzarsi in strutture differenziate può fornire un modo per costruire contemporaneamente i tessuti e formare popolazioni cellulari distinte, migliorando l’efficacia e la funzionalità della stampa di organi.