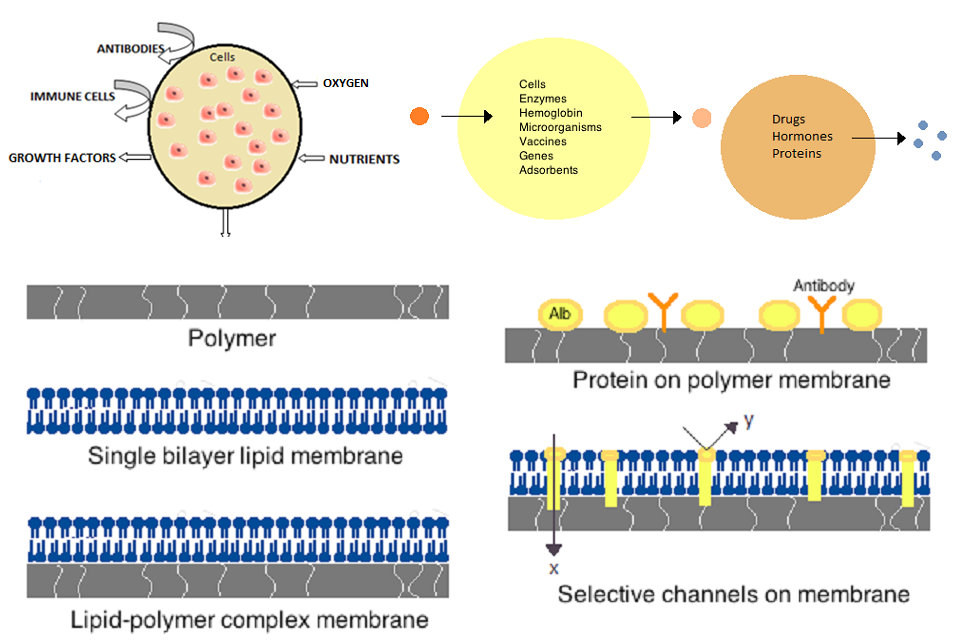
Una cellula artificiale o una cellula minima è una particella ingegnerizzata che imita una o più funzioni di una cellula biologica. Il termine non si riferisce a una specifica entità fisica, ma piuttosto all’idea che determinate funzioni o strutture di cellule biologiche possono essere sostituite o integrate con un’entità sintetica. Spesso, le cellule artificiali sono membrane biologiche o polimeriche che racchiudono materiali biologicamente attivi. Come tali, nanoparticelle, liposomi, polimeriomi, microcapsule e un certo numero di altre particelle si sono qualificate come cellule artificiali. La microincapsulazione consente il metabolismo all’interno della membrana, lo scambio di piccole molecole e la prevenzione del passaggio di grandi sostanze attraverso di essa. I principali vantaggi dell’incapsulamento includono il miglioramento del mimetismo nell’organismo, l’aumento della solubilità del carico e la diminuzione delle risposte immunitarie. In particolare, le cellule artificiali hanno avuto successo clinico nell’emoperfusione.
Nell’ambito della biologia sintetica, una cellula artificiale “vivente” è stata definita come una cellula completamente sinteticamente prodotta in grado di catturare energia, mantenere gradienti ionici, contenere macromolecole e memorizzare informazioni e avere la capacità di mutare. Una cellula del genere non è ancora tecnicamente fattibile, ma è stata creata una variazione di una cellula artificiale in cui un genoma completamente sintetico è stato introdotto nelle cellule ospiti svuotate genomicamente. Sebbene non sia completamente artificiale perché i componenti citoplasmatici e la membrana della cellula ospite sono mantenuti, la cellula ingegnerizzata è sotto il controllo di un genoma sintetico ed è in grado di replicarsi.
Storia
Le prime cellule artificiali furono sviluppate da Thomas Chang alla McGill University negli anni ’60. Queste cellule consistevano in membrane ultrasottili di nylon, collodio o proteina reticolata le cui proprietà semipermeabili permettevano la diffusione di piccole molecole dentro e fuori la cellula. Queste cellule erano di dimensioni micron e contenevano cellule, enzimi, emoglobina, materiali magnetici, adsorbenti e proteine.
Le cellule artificiali successive hanno spaziato da dimensioni da cento micrometri a nanometri e possono trasportare microrganismi, vaccini, geni, droghe, ormoni e peptidi. Il primo uso clinico di cellule artificiali era in emoperfusione mediante l’incapsulamento di carbone attivo.
Negli anni ’70, i ricercatori sono stati in grado di introdurre enzimi, proteine e ormoni in microcapsule biodegradabili, portando successivamente all’uso clinico in malattie come la sindrome di Lesch-Nyhan. Sebbene la ricerca iniziale di Chang fosse incentrata sui globuli rossi artificiali, solo a metà degli anni ’90 si svilupparono i globuli rossi artificiali biodegradabili. Le cellule artificiali in incapsulamento di cellule biologiche sono state utilizzate per la prima volta nella clinica nel 1994 per il trattamento in un paziente diabetico e da allora altri tipi di cellule come epatociti, cellule staminali adulte e cellule geneticamente ingegnerizzate sono state incapsulate e sono allo studio per la rigenerazione dei tessuti .
Il 29 dicembre 2011, i chimici dell’Università di Harvard hanno riferito della creazione di una membrana cellulare artificiale.
Entro il 2014 sono state prodotte cellule batteriche sintetiche auto-replicanti con pareti cellulari e DNA sintetico. Nel gennaio di quell’anno i ricercatori hanno prodotto una cellula eucariotica artificiale in grado di effettuare molteplici reazioni chimiche attraverso gli organelli di lavoro.
Nel settembre 2018, i ricercatori dell’Università della California hanno sviluppato cellule artificiali in grado di uccidere i batteri. Le cellule sono state progettate dal basso verso l’alto – come i blocchi Lego – per distruggere i batteri.
materiale
Le membrane per le cellule artificiali sono costituite da semplici polimeri, proteine reticolate, membrane lipidiche o complessi polimero-lipidici. Inoltre, le membrane possono essere ingegnerizzate per presentare proteine superficiali quali albumina, antigeni, portatori di Na / K-ATPasi o pori come i canali ionici. I materiali comunemente usati per la produzione di membrane includono polimeri idrogel come alginato, cellulosa e polimeri termoplastici come idrossietil metacrilato-metilmetacrilato (HEMA-MMA), poliacrilonitrile-polivinilcloruro (PAN-PVC), nonché variazioni del suddetto menzionato. Il materiale utilizzato determina la permeabilità della membrana cellulare, che per il polimero dipende dal peso molecolare interrotto (MWCO). Il MWCO è il peso molecolare massimo di una molecola che può liberamente passare attraverso i pori ed è importante per determinare un’adeguata diffusione di nutrienti, rifiuti e altre molecole critiche. I polimeri idrofili hanno il potenziale per essere biocompatibili e possono essere fabbricati in una varietà di forme che includono micelle polimeriche, miscele sol-gel, miscele fisiche e particelle reticolate e nanoparticelle. Di particolare interesse sono i polimeri stimolanti che rispondono al pH o alle variazioni di temperatura per l’uso nella consegna mirata. Questi polimeri possono essere somministrati sotto forma liquida attraverso un’iniezione macroscopica e solidificare o gelificare in situ a causa della differenza di pH o temperatura. Preparazioni di nanoparticelle e liposomi sono anche abitualmente utilizzate per l’incapsulamento e la consegna del materiale. Uno dei principali vantaggi dei liposomi è la loro capacità di fondere le membrane cellulari e organelle.
Preparazione
Sono state sviluppate molte varianti per la preparazione e l’incapsulamento di cellule artificiali. Tipicamente, vengono sintetizzate vescicole come una nanoparticella, un polimero o un liposoma. Un’emulsione viene tipicamente realizzata attraverso l’uso di apparecchiature ad alta pressione come un omogeneizzatore ad alta pressione o un microfluidificatore. Di seguito sono descritti due metodi di microincapsulazione per la nitrocellulosa.
Omogeneizzazione ad alta pressione
In un omogeneizzatore ad alta pressione, due liquidi in sospensione olio / liquido vengono forzati attraverso un piccolo orifizio a pressione molto elevata. Questo processo divide i prodotti e consente la creazione di particelle estremamente fini, piccole come 1 nm.
Microfluidization
Questa tecnica utilizza un microfluidificatore brevettato per ottenere una maggiore quantità di sospensioni omogenee che possono creare particelle più piccole rispetto agli omogeneizzatori. Un omogeneizzatore viene utilizzato per la prima volta per creare una sospensione grossolana che viene poi pompata nel microfluidificatore ad alta pressione. Il flusso viene quindi suddiviso in due flussi che reagiscono a velocità molto elevate in una camera di interazione fino a ottenere la dimensione delle particelle desiderata. Questa tecnica consente la produzione su larga scala di liposomi fosfolipidi e successive nanoencapsulazioni di materiale.
Metodo di caduta
In questo metodo, una soluzione cellulare viene incorporata a gocce in una soluzione a collodio di nitrato di cellulosa. Quando la goccia attraversa il collodio, viene rivestita con una membrana grazie alle proprietà di polimerizzazione dell’interfaccia del collodio. La cellula si deposita in seguito in paraffina dove la membrana si fissa e viene infine sospesa una soluzione salina. Il metodo drop viene utilizzato per la creazione di grandi cellule artificiali che incapsulano cellule biologiche, cellule staminali e cellule staminali geneticamente modificate.
Metodo di emulsione
Il metodo di emulsione differisce dal fatto che il materiale da incapsulare è solitamente più piccolo ed è posto sul fondo di una camera di reazione in cui il collodio viene aggiunto sopra e centrifugato, o altrimenti disturbato per creare un’emulsione. Il materiale incapsulato viene quindi disperso e sospeso in soluzione salina.
Rilevanza clinica
Rilascio e consegna di farmaci
Le cellule artificiali utilizzate per il rilascio di farmaci differiscono da altre cellule artificiali poiché il loro contenuto è destinato a diffondersi fuori dalla membrana, o essere inghiottito e digerito da una cellula bersaglio ospite. Spesso utilizzate sono le cellule artificiali submicroniche, a membrana lipidica che possono essere indicate come nanocapsule, nanoparticelle, polimeriomi o altre varianti del termine.
Terapia enzimatica
La terapia enzimatica viene attivamente studiata per le malattie metaboliche genetiche in cui un enzima è sovraespresso, sottoespresso, difettoso o non presente affatto. Nel caso di sottoespressione o espressione di un enzima difettoso, una forma attiva dell’enzima viene introdotta nel corpo per compensare il deficit. D’altra parte, una sovraespressione enzimatica può essere neutralizzata dall’introduzione di un enzima non funzionale in competizione; cioè, un enzima che metabolizza il substrato in prodotti non attivi. Se collocati all’interno di una cellula artificiale, gli enzimi possono svolgere la loro funzione per un periodo molto più lungo rispetto agli enzimi liberi e possono essere ulteriormente ottimizzati mediante coniugazione del polimero.
Il primo enzima studiato con incapsulamento di cellule artificiali era asparaginasi per il trattamento del linfosarcoma nei topi. Questo trattamento ha ritardato l’inizio e la crescita del tumore. Questi risultati iniziali hanno portato a ulteriori ricerche sull’uso di cellule artificiali per il rilascio di enzimi nei melanomi dipendenti dalla tirosina. Questi tumori hanno una maggiore dipendenza dalla tirosina rispetto alle cellule normali per la crescita e la ricerca ha dimostrato che l’abbassamento dei livelli sistemici di tirosina nei topi può inibire la crescita dei melanomi. L’uso di cellule artificiali nell’erogazione di tirosinasi; e l’enzima che digerisce la tirosina, consente una migliore stabilità enzimatica e si dimostra efficace nella rimozione della tirosina senza i gravi effetti collaterali associati alla depravazione della tirosina nella dieta.
La terapia con enzimi cellulari artificiali è anche di interesse per l’attivazione di profarmaci come l’ifosfamide in alcuni tumori. Le cellule artificiali che incapsulano l’enzima del citocromo p450 che converte questo profarmaco nel farmaco attivo possono essere adattate per accumularsi nel carcinoma pancreatico o impiantare le cellule artificiali vicino al sito del tumore. Qui, la concentrazione locale dell’ifosfamide attivato sarà molto più elevata rispetto al resto del corpo, prevenendo così la tossicità sistemica. Il trattamento ha avuto successo negli animali e ha mostrato un raddoppio della sopravvivenza mediana tra i pazienti con carcinoma pancreatico in stadio avanzato nelle sperimentazioni cliniche di fase I / II e una triplicazione del tasso di sopravvivenza a un anno.
Terapia genetica
Nel trattamento delle malattie genetiche, la terapia genica mira a inserire, modificare o rimuovere i geni all’interno delle cellule di un individuo afflitto. La tecnologia si basa fortemente su vettori virali che solleva preoccupazioni circa la mutagenesi inserzionale e la risposta immunitaria sistemica che hanno portato a decessi umani e allo sviluppo della leucemia in studi clinici. Evitare il bisogno di vettori utilizzando il DNA nudo o plasmidico come proprio sistema di somministrazione incontra anche problemi come l’efficienza di trasduzione ridotta e il targeting dei tessuti poveri quando somministrati sistemicamente.
Le cellule artificiali sono state proposte come vettore non virale mediante il quale cellule non-autologhe geneticamente modificate sono incapsulate e impiantate per fornire proteine ricombinanti in vivo. Questo tipo di immuno-isolamento è stato dimostrato efficace nei topi attraverso il rilascio di cellule artificiali contenenti l’ormone della crescita del topo che ha salvato un ritardo della crescita in topi mutanti. Alcune strategie sono passate agli studi clinici sull’uomo per il trattamento del cancro del pancreas, della sclerosi laterale e del controllo del dolore.
emoperfusione
Il primo uso clinico di cellule artificiali era in emoperfusione mediante l’incapsulamento di carbone attivo. Il carbone attivo ha la capacità di assorbire molte molecole di grandi dimensioni e da tempo è noto per la sua capacità di rimuovere sostanze tossiche dal sangue in avvelenamento accidentale o sovradosaggio. Tuttavia, la perfusione attraverso la somministrazione diretta di carbone è tossica in quanto conduce a embolie e danni alle cellule del sangue seguite dalla rimozione mediante piastrine. Le cellule artificiali consentono alle tossine di diffondersi nella cellula mantenendo il carico pericoloso all’interno della loro membrana ultrasottile.
L’emoperfusione delle cellule artificiali è stata proposta come opzione di disintossicazione meno costosa ed efficiente rispetto all’emodialisi, in cui il filtraggio del sangue avviene solo attraverso la separazione delle dimensioni da una membrana fisica. Nell’emoperfusione, migliaia di cellule artificiali adsorbenti vengono trattenute all’interno di un piccolo contenitore attraverso l’uso di due schermi su entrambe le estremità attraverso le quali il sangue del paziente perfusi. Mentre il sangue circola, le tossine o le droghe si diffondono nelle cellule e vengono trattenute dal materiale assorbente. Le membrane delle cellule artificiali sono molto più sottili di quelle utilizzate nella dialisi e le loro piccole dimensioni significano che hanno una superficie di membrana alta. Ciò significa che una porzione di cellula può avere un trasferimento di massa teorico che è cento volte più alto di quello di una intera macchina artificiale per reni. Il dispositivo è stato stabilito come metodo clinico di routine per i pazienti trattati per avvelenamento accidentale o suicidario, ma è stato anche introdotto come terapia per insufficienza epatica e insufficienza renale svolgendo parte della funzione di questi organi. L’emoperfusione di cellule artificiali è stata anche proposta per l’uso in immunoassorbimento attraverso il quale gli anticorpi possono essere rimossi dal corpo attaccando un materiale immunoadsorbente come l’albumina sulla superficie delle cellule artificiali. Questo principio è stato utilizzato per rimuovere gli anticorpi del gruppo sanguigno dal plasma per il trapianto di midollo osseo e per il trattamento dell’ipercolesterolemia attraverso gli anticorpi monoclonali per rimuovere le lipoproteine a bassa densità. L’emoperfusione è particolarmente utile in paesi con un settore manifatturiero in emodialisi debole poiché i dispositivi tendono ad essere più economici e utilizzati in pazienti con insufficienza renale.
Cellule incapsulate
Il metodo più comune di preparazione delle cellule artificiali è attraverso l’incapsulamento cellulare. Le cellule incapsulate sono tipicamente ottenute attraverso la generazione di goccioline di dimensioni controllate da una sospensione di cellule liquide che vengono quindi rapidamente solidificate o gelate per fornire una maggiore stabilità. La stabilizzazione può essere ottenuta attraverso un cambiamento di temperatura o tramite reticolazione del materiale. Il microambiente che una cellula vede cambiamenti all’incapsulamento. Tipicamente passa dall’essere su un monostrato a una sospensione in uno scaffold polimerico all’interno di una membrana polimerica. Un inconveniente della tecnica è che incapsulare una cellula diminuisce la sua vitalità e capacità di proliferare e differenziarsi. Inoltre, dopo un certo tempo all’interno della microcapsula, le cellule formano gruppi che inibiscono lo scambio di ossigeno e di rifiuti metabolici, portando ad apoptosi e necrosi limitando così l’efficacia delle cellule e attivando il sistema immunitario dell’ospite. Le cellule artificiali hanno avuto successo nel trapiantare un certo numero di cellule comprese le isole di Langerhans per il trattamento del diabete, le cellule paratiroidee e le cellule della corteccia surrenale.
Epatociti incapsulati
La carenza di donatori di organi rende le cellule artificiali protagoniste di terapie alternative per l’insufficienza epatica. L’uso di cellule artificiali per il trapianto di epatociti ha dimostrato la fattibilità e l’efficacia nel fornire funzionalità epatica in modelli di malattia epatica animale e dispositivi di fegato bioartificiale. La ricerca ha derivato da esperimenti in cui gli epatociti erano attaccati alla superficie di un micro-portatore e si sono evoluti in epatociti che sono incapsulati in una matrice tridimensionale in microgoccioline di alginato ricoperte da una pelle esterna di polilisina. Un vantaggio chiave di questo metodo di somministrazione è l’elusione della terapia immunosoppressiva per la durata del trattamento. Gli incapsulamenti di epatociti sono stati proposti per l’uso in un fegato bioartifico. Il dispositivo è costituito da una camera cilindrica integrata con epatociti isolati attraverso cui il plasma del paziente viene fatto circolare extra-corporeo in un tipo di emoperfusione. Poiché le microcapsule hanno un elevato rapporto tra superficie e volume, forniscono un’ampia superficie per la diffusione del substrato e possono ospitare un gran numero di epatociti. Il trattamento dei topi con insufficienza epatica indotta ha mostrato un aumento significativo del tasso di sopravvivenza. I sistemi epatici artificiali sono ancora in fase di sviluppo precoce, ma mostrano potenziale per i pazienti in attesa di trapianto di organi o mentre il fegato di un paziente si rigenera sufficientemente per riprendere la normale funzione. Finora, gli studi clinici che hanno utilizzato sistemi epatici artificiali e il trapianto di epatociti nelle malattie epatiche allo stadio terminale hanno mostrato un miglioramento dei marcatori della salute, ma non hanno ancora migliorato la sopravvivenza. La breve longevità e l’aggregazione degli epatociti artificiali dopo il trapianto sono i principali ostacoli incontrati. Gli epatociti co-incapsulati con cellule staminali mostrano una maggiore vitalità in coltura e dopo l’impianto e l’impianto di cellule staminali artificiali da soli hanno anche mostrato la rigenerazione epatica. Come tale interesse è sorto nell’uso di cellule staminali per l’incapsulamento nella medicina rigenerativa.
Cellule batteriche incapsulate
L’ingestione orale di colonie di cellule batteriche vive è stata proposta ed è attualmente in terapia per la modulazione della microflora intestinale, la prevenzione delle malattie diarroiche, il trattamento delle infezioni da H. Pylori, le infiammazioni atopiche, l’intolleranza al lattosio e la modulazione immunitaria, tra gli altri. Il meccanismo d’azione proposto non è completamente compreso ma si ritiene che abbia due effetti principali. Il primo è l’effetto nutrizionale, in cui i batteri competono con i batteri che producono tossine. Il secondo è l’effetto sanitario, che stimola la resistenza alla colonizzazione e stimola la risposta immunitaria. La consegna orale di colture batteriche è spesso un problema perché sono prese di mira dal sistema immunitario e spesso distrutte se assunte per via orale. Le cellule artificiali aiutano a risolvere questi problemi fornendo mimetismo nel corpo e rilascio selettivo o a lungo termine aumentando così la vitalità dei batteri che raggiungono il sistema gastrointestinale. Inoltre, l’incapsulamento di cellule batteriche vive può essere progettato per consentire la diffusione di piccole molecole inclusi i peptidi nel corpo a scopo terapeutico. Le membrane che si sono dimostrate efficaci per il rilascio di batteri includono acetato di cellulosa e varianti di alginato. Ulteriori usi derivati dall’incapsulamento delle cellule batteriche includono la protezione contro la sfida di M. Tuberculosis e la sovraregolazione delle cellule che secernono le Ig dal sistema immunitario. La tecnologia è limitata dal rischio di infezioni sistemiche, attività metaboliche avverse e rischio di trasferimento genico. Tuttavia, la sfida maggiore rimane la consegna di batteri vitali sufficienti al sito di interesse.
Globulo artificiale
Trasportatori di ossigeno
I portatori di ossigeno di dimensioni nane sono usati come un tipo di sostituti dei globuli rossi, sebbene manchino di altri componenti dei globuli rossi. Sono composti da un polimero sintetico o una membrana artificiale che circonda l’emoglobina animale purificata, umana o ricombinante. Nel complesso, la somministrazione di emoglobina continua ad essere una sfida perché è altamente tossica quando viene erogata senza alcuna modifica. In alcuni studi clinici, sono stati osservati effetti vasopressori per i sostituti del sangue di emoglobina di prima generazione.
globuli rossi
L’interesse per la ricerca sull’uso di cellule artificiali per il sangue è sorto dopo lo spavento dell’AIDS degli anni ’80. Oltre a bypassare il potenziale di trasmissione della malattia, i globuli rossi artificiali sono desiderati perché eliminano gli inconvenienti associati alle trasfusioni di sangue allogeniche come la tipizzazione del sangue, le reazioni immunitarie e la sua breve durata di conservazione di 42 giorni. Un sostituto dell’emoglobina può essere conservato a temperatura ambiente e non sotto refrigerazione per più di un anno. Sono stati fatti tentativi per sviluppare un globulo rosso funzionante completo che comprende carboni non solo un vettore di ossigeno ma anche gli enzimi associati con la cellula. Il primo tentativo fu fatto nel 1957 sostituendo la membrana dei globuli rossi con una membrana polimerica ultrasottile che fu seguita dall’incapsulamento attraverso una membrana lipidica e più recentemente da una membrana polimerica biodegradabile. Una membrana biologica dei globuli rossi, compresi i lipidi e le proteine associate, può anche essere utilizzata per incapsulare le nanoparticelle e aumentare il tempo di residenza in vivo bypassando l’assorbimento dei macrofagi e la clearance sistemica.
Leuko-polymersome
Un polimero leuco-polimerico è un polimero progettato per avere le proprietà adesive di un leucocita. I polimeri sono vescicole composte da un foglio di doppio strato che può incapsulare molte molecole attive come farmaci o enzimi. Aggiungendo le proprietà adesive di un leucocita alle loro membrane, possono essere fatte rallentare o rotolare lungo le pareti epiteliali all’interno del sistema circolatorio che scorre rapidamente.
Cellule sintetiche
La cella minima
Il patologo tedesco Rudolf Virchow ha portato avanti l’idea che non solo la vita nasce dalle cellule, ma ogni cellula viene da un’altra cellula; “Omnis cellula e cellula”. Fino ad ora, la maggior parte dei tentativi di creare una cella artificiale ha creato solo un pacchetto che può imitare determinati compiti della cella. I progressi nella trascrizione cellulare e le reazioni di traduzione consentono l’espressione di molti geni, ma questi sforzi sono lontani dal produrre una cellula pienamente operativa.
Il futuro è nella creazione di una protocella o di una cellula che ha tutti i requisiti minimi per la vita. I membri del J. Craig Venter Institute hanno utilizzato un approccio computazionale top-down per mettere fuori uso i geni di un organismo vivente su un insieme minimo di geni. Nel 2010, il team è riuscito a creare un ceppo replicante di Mycooplasma mycoides (Mycoplasma Laboratoryum) utilizzando DNA sinteticamente creato ritenuto il requisito minimo per la vita che è stato inserito in un batterio genomicamente vuoto. Si spera che il processo di biosintesi top-down consentirà l’inserimento di nuovi geni che potrebbero svolgere funzioni redditizie come la generazione di idrogeno per il carburante o la cattura di biossido di carbonio in eccesso nell’atmosfera. la miriade di reti regolatorie, metaboliche e di segnalazione non sono completamente caratterizzate. Questi approcci top-down hanno limitazioni per la comprensione della regolazione molecolare fondamentale, poiché gli organismi ospiti hanno una composizione molecolare complessa e non completamente definita.
Un approccio dal basso verso l’alto per costruire una cellula artificiale implicherebbe la creazione di un protocell de novo, interamente da materiali non viventi. Si propone di creare una vescicola di doppio strato fosfolipidico con DNA capace di auto-riprodursi usando informazioni genetiche sintetiche. I tre elementi primari di tali cellule artificiali sono la formazione di una membrana lipidica, la replicazione del DNA e dell’RNA attraverso un processo di templatura e la raccolta di energia chimica per il trasporto attivo attraverso la membrana. Gli ostacoli principali previsti e incontrati con questa proposta di protocell sono la creazione di un DNA sintetico minimo che contiene tutte le informazioni sufficienti per la vita e la riproduzione di componenti non genetiche che sono parte integrante dello sviluppo cellulare come l’auto-organizzazione molecolare. Tuttavia, si spera che questo tipo di approccio dal basso verso l’alto possa fornire una panoramica delle questioni fondamentali delle organizzazioni a livello cellulare e delle origini della vita biologica. Finora, nessuna cellula completamente artificiale capace di auto-riprodursi è stata sintetizzata usando le molecole della vita, e questo obiettivo è ancora in un futuro lontano, sebbene vari gruppi stiano attualmente lavorando per raggiungere questo obiettivo.
Un altro metodo proposto per creare una protocella ricorda più da vicino le condizioni che si ritiene siano state presenti durante l’evoluzione nota come zuppa primordiale. Vari polimeri di RNA potrebbero essere incapsulati in vescicole e in così piccole condizioni al contorno, per cui sarebbero state testate le reazioni chimiche.
Investimenti pesanti in biologia sono stati fatti da grandi aziende come ExxonMobil, che ha collaborato con Synthetic Genomics Inc; La società di biosintetici di Craig Venter nello sviluppo di carburanti dalle alghe.
Cella artificiale elettronica
Il concetto di una cella artificiale elettronica è stato ampliato in una serie di 3 progetti dell’UE coordinati da John McCaskill dal 2004 al 2015.
La Commissione europea ha sponsorizzato lo sviluppo del programma “Evoluzione di celle artificiali programmabili” (PACE) dal 2004 al 2008 il cui obiettivo era gettare le basi per la creazione di “entità microscopiche auto-organizzanti, auto-replicanti ed evolutive costruite da semplici sostanze organiche e inorganiche che possono essere geneticamente programmate per svolgere funzioni specifiche “per l’eventuale integrazione in sistemi di informazione. Il progetto PACE ha sviluppato la prima macchina Omega, un sistema di supporto vitale microfluidico per cellule artificiali che potrebbe completare le funzionalità mancanti (come originariamente proposto da Norman Packard, Steen Rasmussen, Mark Beadau e John McCaskill). L’obiettivo finale era quello di raggiungere una cellula ibrida evolvibile in un complesso ambiente programmabile in microscala. Le funzioni della Macchina Omega potrebbero quindi essere rimosse gradualmente, ponendo una serie di sfide risolutive di evoluzione alla chimica delle cellule artificiali. Il progetto ha raggiunto l’integrazione chimica fino al livello di coppie delle tre funzioni fondamentali delle cellule artificiali (un sottosistema genetico, un sistema di contenimento e un sistema metabolico) e ha generato nuovi ambienti microfluidici programmabili spazialmente risolti per l’integrazione del contenimento e dell’amplificazione genetica. “Evoluzione programmabile delle celle artificiali” (PACE) Il progetto ha portato alla creazione del centro europeo per la tecnologia vivente] che sta ora proseguendo ricerche simili.
A seguito di questa ricerca, nel 2007, John McCaskill propose di concentrarsi su una cellula artificiale integrata elettronicamente, chiamata Electronic Chemical Cell. L’idea chiave era di utilizzare una serie di elettrodi massicciamente parallela accoppiata a circuiti elettronici dedicati localmente, in un film sottile bidimensionale, per integrare la funzionalità cellulare chimica emergente. Le informazioni elettroniche locali che definiscono i circuiti di commutazione e di rilevamento degli elettrodi potrebbero fungere da genoma elettronico, integrando le informazioni sequenziali molecolari nei protocolli emergenti. Una proposta di ricerca ha avuto successo con la Commissione europea e un gruppo internazionale di scienziati parzialmente sovrapposti con il consorzio PACE ha iniziato il lavoro 2008-2012 sul progetto Electronic Chemical Cells. Il progetto ha dimostrato tra le altre cose che il trasporto locale controllato elettronicamente di sequenze specifiche potrebbe essere usato come un sistema di controllo spaziale artificiale per la proliferazione genetica di future cellule artificiali e che i processi fondamentali del metabolismo potrebbero essere forniti da array di elettrodi opportunamente rivestiti.
La principale limitazione di questo approccio, a parte le difficoltà iniziali nel padroneggiare l’elettrochimica e l’elettrocinetica su microscala, è che il sistema elettronico è interconnesso come un pezzo rigido non autonomo di hardware macroscopico. Nel 2011 McCaskill propose di invertire la geometria dell’elettronica e della chimica: invece di collocare le sostanze chimiche in un mezzo elettronico attivo, collocare l’elettronica autonoma microscopica in un mezzo chimico. Ha organizzato un progetto per affrontare una terza generazione di celle artificiali elettroniche alla scala di 100 μm che potrebbe autoassemblarsi da due “lablets” di semicelle per racchiudere uno spazio chimico interno e funzionare con l’ausilio di un’elettronica attiva alimentata dal medium sono immerse in. Queste cellule possono copiare sia i loro contenuti elettronici che chimici e saranno capaci di evolvere entro i vincoli forniti dai loro particolari componenti microscopici pre-sintetizzati. A settembre 2012 sono iniziati i lavori per questo progetto Microscale Chemically Reactive Electronic Agents.
Etica e controversie
La ricerca di Protocell ha creato polemiche e opinioni contrastanti, compresi i critici della vaga definizione di “vita artificiale”. La creazione di un’unità base della vita è la preoccupazione etica più urgente, anche se la preoccupazione più diffusa sui protocell è la loro potenziale minaccia alla salute umana e all’ambiente attraverso la replicazione incontrollata.