Eine künstliche Zelle oder minimale Zelle ist ein technisch hergestelltes Teilchen, das eine oder viele Funktionen einer biologischen Zelle nachahmt. Der Begriff bezieht sich nicht auf eine bestimmte physikalische Entität, sondern auf die Idee, dass bestimmte Funktionen oder Strukturen biologischer Zellen durch eine synthetische Entität ersetzt oder ergänzt werden können. Künstliche Zellen sind oft biologische oder polymere Membranen, die biologisch aktive Materialien einschließen. Nanopartikel, Liposomen, Polymersome, Mikrokapseln und eine Reihe anderer Partikel haben sich als künstliche Zellen qualifiziert. Die Mikroverkapselung ermöglicht den Metabolismus in der Membran, den Austausch kleiner Moleküle und die Verhinderung des Durchtritts großer Substanzen. Die Hauptvorteile der Einkapselung umfassen eine verbesserte Mimikry im Körper, eine erhöhte Löslichkeit der Ladung und verminderte Immunreaktionen. Insbesondere waren künstliche Zellen bei der Hämoperfusion klinisch erfolgreich.
Im Bereich der synthetischen Biologie wurde eine „lebende“ künstliche Zelle als vollständig synthetisch hergestellte Zelle definiert, die Energie aufnehmen, Ionengradienten beibehalten, Makromoleküle enthalten sowie Informationen speichern und mutieren kann. Eine solche Zelle ist technisch noch nicht machbar, aber es wurde eine Variante einer künstlichen Zelle geschaffen, bei der ein vollständig synthetisches Genom in genomisch entleerte Wirtszellen eingeführt wurde. Obwohl nicht vollständig künstlich, da die zytoplasmatischen Komponenten sowie die Membran aus der Wirtszelle erhalten bleiben, steht die konstruierte Zelle unter der Kontrolle eines synthetischen Genoms und kann sich replizieren.
Geschichte
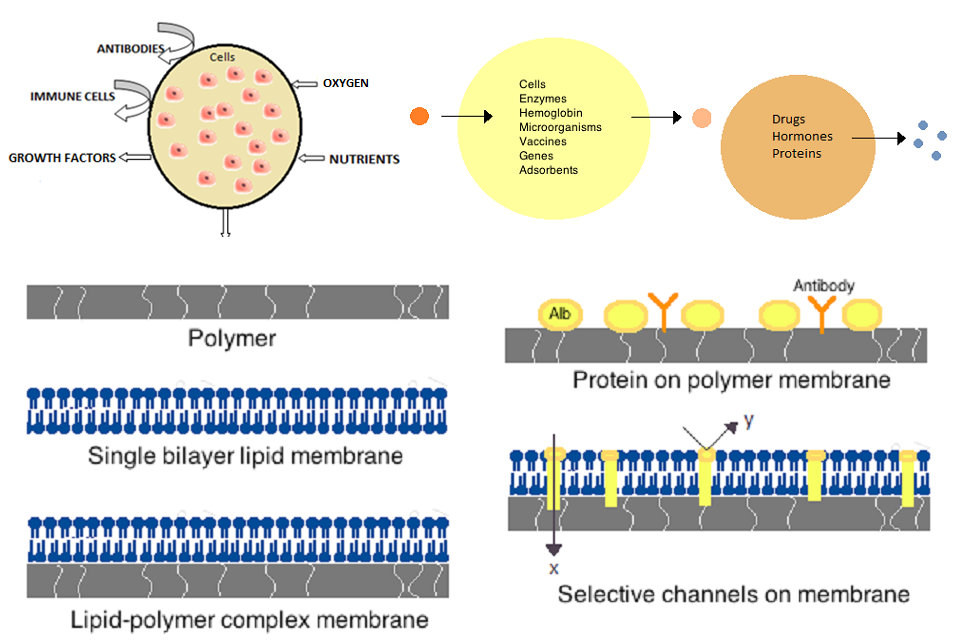
Die ersten künstlichen Zellen wurden in den 1960ern von Thomas Chang an der McGill University entwickelt. Diese Zellen bestanden aus ultradünnen Membranen aus Nylon, Kollodium oder vernetztem Protein, deren semipermeable Eigenschaften die Diffusion kleiner Moleküle in und aus der Zelle ermöglichten. Diese Zellen waren im Mikrometerbereich und enthielten Zellen, Enzyme, Hämoglobin, magnetische Materialien, Adsorbentien und Proteine.
Spätere künstliche Zellen hatten eine Größe von hundert Mikrometern bis zu Nanometern und können Mikroorganismen, Impfstoffe, Gene, Medikamente, Hormone und Peptide transportieren. Der erste klinische Einsatz künstlicher Zellen bestand in der Hämoperfusion durch die Einkapselung von Aktivkohle.
In den 70er Jahren konnten Forscher Enzyme, Proteine und Hormone biologisch abbaubaren Mikrokapseln einführen, die später bei Krankheiten wie dem Lesch-Nyhan-Syndrom klinisch eingesetzt wurden. Obwohl sich die ersten Forschungen von Chang auf künstliche rote Blutkörperchen konzentrierten, wurden erst Mitte der 1990er Jahre biologisch abbaubare künstliche rote Blutkörperchen entwickelt. Künstliche Zellen bei der biologischen Zellverkapselung wurden erstmals 1994 in der Klinik zur Behandlung eines Diabetikers eingesetzt. Seitdem wurden andere Zelltypen wie Hepatozyten, adulte Stammzellen und gentechnisch veränderte Zellen verkapselt und werden derzeit zur Geweberegeneration untersucht .
Am 29. Dezember 2011 berichteten Chemiker der Harvard University über die Schaffung einer künstlichen Zellmembran.
Bis 2014 wurden selbstreplizierende, synthetische Bakterienzellen mit Zellwänden und synthetischer DNA hergestellt. Im Januar dieses Jahres stellten die Forscher eine künstliche eukaryontische Zelle her, die in der Lage ist, durch funktionierende Organellen mehrere chemische Reaktionen durchzuführen.
Im September 2018 entwickelten Forscher der University of California künstliche Zellen, die Bakterien abtöten können. Die Zellen wurden wie die Lego-Blöcke von unten nach oben konstruiert, um Bakterien zu zerstören.
Materialien
Membranen für künstliche Zellen bestehen aus einfachen Polymeren, vernetzten Proteinen, Lipidmembranen oder Polymer-Lipid-Komplexen. Ferner können Membranen so konstruiert werden, dass sie Oberflächenproteine wie Albumin, Antigene, Na / K-ATPase-Träger oder Poren wie Ionenkanäle präsentieren. Üblicherweise verwendete Materialien zur Herstellung von Membranen umfassen Hydrogelpolymere wie Alginat, Cellulose und thermoplastische Polymere wie Hydroxyethylmethacrylat-Methylmethacrylat (HEMA-MMA), Polyacrylnitril-Polyvinylchlorid (PAN-PVC) sowie Variationen der obigen. erwähnt. Das verwendete Material bestimmt die Permeabilität der Zellmembran, die für das Polymer von der Molekulargewichtsgrenze (MWCO) abhängt. Das MWCO ist das maximale Molekulargewicht eines Moleküls, das die Poren frei passieren kann, und ist für die Bestimmung einer ausreichenden Diffusion von Nährstoffen, Abfällen und anderen kritischen Molekülen wichtig. Hydrophile Polymere können biokompatibel sein und können in einer Vielzahl von Formen hergestellt werden, zu denen Polymermizellen, Sol-Gel-Gemische, physikalische Mischungen und vernetzte Partikel und Nanopartikel gehören. Von besonderem Interesse sind auf Stimuli ansprechende Polymere, die auf pH- oder Temperaturänderungen für die gezielte Abgabe reagieren. Diese Polymere können in flüssiger Form durch eine makroskopische Injektion verabreicht werden und aufgrund des Unterschieds im pH-Wert oder in der Temperatur in situ verfestigen oder gelieren. Nanopartikel- und Liposomenpräparate werden auch routinemäßig zur Materialeinkapselung und -abgabe verwendet. Ein großer Vorteil von Liposomen ist ihre Fähigkeit, an Zell- und Organellenmembranen zu fusionieren.
Vorbereitung
Es wurden viele Variationen für die künstliche Zellpräparation und Verkapselung entwickelt. Typischerweise werden Vesikel wie Nanopartikel, Polymersome oder Liposome synthetisiert. Eine Emulsion wird typischerweise unter Verwendung einer Hochdruckausrüstung wie eines Hochdruckhomogenisators oder eines Mikrofluidisators hergestellt. Zwei Mikroverkapselungsverfahren für Nitrocellulose werden nachstehend ebenfalls beschrieben.
Homogenisierung unter hohem Druck
In einem Hochdruckhomogenisator werden zwei Flüssigkeiten in Öl / Flüssigkeits-Suspension unter sehr hohem Druck durch eine kleine Öffnung gedrückt. Dieser Prozess teilt die Produkte auf und ermöglicht die Erzeugung extrem feiner Partikel mit einer Größe von 1 nm.
Mikrofluidisierung
Diese Technik verwendet einen patentierten Microfluidizer, um eine größere Menge homogener Suspensionen zu erhalten, die kleinere Partikel als Homogenisatoren erzeugen können. Zuerst wird mit einem Homogenisator eine grobe Suspension erzeugt, die dann unter hohem Druck in den Mikrofluidisator gepumpt wird. Der Strom wird dann in zwei Ströme aufgeteilt, die bei sehr hohen Geschwindigkeiten in einer Wechselwirkungskammer reagieren, bis die gewünschte Teilchengröße erreicht ist. Diese Technik ermöglicht die Produktion von Phospholipid-Liposomen im großen Maßstab und die anschließenden Material-Nanoverkapselungen.
Drop-Methode
Bei diesem Verfahren wird eine Zelllösung in eine Kollodiumlösung von Cellulosenitrat getropft. Wenn sich der Tropfen durch das Kollodium bewegt, wird er dank der Grenzflächenpolymerisationseigenschaften des Kollodions mit einer Membran beschichtet. Die Zelle setzt sich später in Paraffin ab, wo sich die Membran festsetzt und schließlich eine Salzlösung suspendiert wird. Die Drop-Methode wird zur Erzeugung großer künstlicher Zellen verwendet, die biologische Zellen, Stammzellen und gentechnisch hergestellte Stammzellen einkapseln.
Emulsionsmethode
Das Emulsionsverfahren unterscheidet sich dadurch, dass das einzukapselnde Material normalerweise kleiner ist und im Boden einer Reaktionskammer angeordnet wird, wo das Kollodium oben zugegeben und zentrifugiert oder auf andere Weise gestört wird, um eine Emulsion zu erzeugen. Das eingekapselte Material wird dann in Salzlösung dispergiert und suspendiert.
Klinische Relevanz
Drug Release und Lieferung
Künstliche Zellen, die zur Medikamentenabgabe verwendet werden, unterscheiden sich von anderen künstlichen Zellen, da ihr Inhalt aus der Membran heraus diffundieren oder von einer Wirtszielzelle verschlungen und verdaut werden soll. Häufig werden Submikron-, Lipidmembran-künstliche Zellen verwendet, die als Nanokapseln, Nanopartikel, Polymersomen oder andere Variationen des Begriffs bezeichnet werden können.
Enzymtherapie
Die Enzymtherapie wird aktiv auf genetisch bedingte Stoffwechselkrankheiten untersucht, bei denen ein Enzym dort überexprimiert, unterdrückt, defekt oder überhaupt nicht ist. Im Falle einer Unterdrückung oder Expression eines defekten Enzyms wird eine aktive Form des Enzyms in den Körper eingeführt, um das Defizit zu kompensieren. Auf der anderen Seite kann einer enzymatischen Überexpression entgegengewirkt werden, indem ein konkurrierendes nicht-funktionelles Enzym eingeführt wird; das heißt, ein Enzym, das das Substrat in nichtaktive Produkte umwandelt. In einer künstlichen Zelle angeordnete Enzyme können ihre Funktion im Vergleich zu freien Enzymen viel länger ausüben und durch Polymerkonjugation weiter optimiert werden.
Das erste unter künstlicher Verkapselung von Zellen untersuchte Enzym war Asparaginase zur Behandlung von Lymphosarkomen bei Mäusen. Diese Behandlung verzögerte den Beginn und das Wachstum des Tumors. Diese ersten Ergebnisse führten zu weiteren Forschungen bei der Verwendung künstlicher Zellen zur Enzymabgabe in tyrosinabhängigen Melanomen. Diese Tumore haben eine höhere Abhängigkeit von Tyrosin als normale Zellen für das Wachstum, und Untersuchungen haben gezeigt, dass eine Senkung der systemischen Tyrosinspiegel bei Mäusen das Wachstum von Melanomen hemmen kann. Verwendung von künstlichen Zellen bei der Abgabe von Tyrosinase; und ein Enzym, das Tyrosin verdaut, ermöglicht eine bessere Enzymstabilität und ist wirksam bei der Entfernung von Tyrosin ohne die schweren Nebenwirkungen, die mit der Tyrosindefavation in der Diät verbunden sind.
Die künstliche Zellenzymtherapie ist auch für die Aktivierung von Prodrugs wie Ifosfamid bei bestimmten Krebsarten von Interesse. Künstliche Zellen, die das Cytochrom-p450-Enzym einkapseln, das dieses Prodrug in das aktive Arzneimittel umwandelt, können maßgeschneidert sein, um sich im Pankreaskarzinom anzureichern oder die künstlichen Zellen nahe der Tumorstelle zu implantieren. Hier ist die lokale Konzentration des aktivierten Ifosfamids viel höher als im Rest des Körpers, wodurch systemische Toxizität verhindert wird. Die Behandlung war bei Tieren erfolgreich und zeigte eine Verdoppelung der mittleren Überlebensrate bei Patienten mit fortgeschrittenem Pankreaskarzinom in klinischen Phase I / II-Studien sowie eine Verdreifachung der Überlebensrate nach einem Jahr.
Gentherapie
Bei der Behandlung genetischer Erkrankungen zielt die Gentherapie darauf ab, Gene in den Zellen eines betroffenen Individuums einzuführen, zu verändern oder zu entfernen. Die Technologie stützt sich stark auf virale Vektoren, was zu Besorgnis über Insertionsmutagenese und systemische Immunreaktion Anlass gibt, die in klinischen Studien zum Tod von Menschen und zur Entwicklung von Leukämie geführt haben. Die Umgehung des Bedarfs an Vektoren durch Verwendung von nackter oder Plasmid-DNA als eigenes Abgabesystem stößt auch auf Probleme wie eine geringe Transduktionseffizienz und ein schlechtes Gewebezielen, wenn es systemisch verabreicht wird.
Künstliche Zellen wurden als nicht-viraler Vektor vorgeschlagen, durch den genetisch modifizierte nicht-autologe Zellen eingekapselt und implantiert werden, um rekombinante Proteine in vivo abzugeben. Diese Art der Immunisolierung hat sich bei Mäusen als wirksam erwiesen, indem künstliche Zellen mit Mauswachstumshormon geliefert wurden, die eine Wachstumsverzögerung in mutierten Mäusen retteten. Einige Strategien haben sich zu klinischen Versuchen mit Menschen entwickelt, um Bauchspeicheldrüsenkrebs, Lateralsklerose und Schmerzkontrolle zu behandeln.
Hämoperfusion
Der erste klinische Einsatz künstlicher Zellen bestand in der Hämoperfusion durch die Einkapselung von Aktivkohle. Aktivkohle hat die Fähigkeit, viele große Moleküle zu adsorbieren, und seit langem ist bekannt, dass sie bei versehentlicher Vergiftung oder Überdosis giftige Substanzen aus dem Blut entfernen kann. Die Perfusion durch direkte Holzkohleverabreichung ist jedoch toxisch, da sie zu Embolien und Schädigungen der Blutzellen führt, gefolgt von der Entfernung durch Blutplättchen. Künstliche Zellen ermöglichen die Diffusion von Toxinen in die Zelle, während die gefährliche Ladung in ihrer ultradünnen Membran bleibt.
Künstliche Zellhämoperfusion wurde als weniger kostenintensive und effizientere Entgiftungsoption vorgeschlagen als die Hämodialyse, bei der die Blutfilterung nur durch Größenabscheidung durch eine physikalische Membran erfolgt. Bei der Hämoperfusion werden Tausende von adsorbierenden künstlichen Zellen durch die Verwendung von zwei Bildschirmen an beiden Enden in einem kleinen Behälter gehalten, durch die das Blut des Patienten durchströmt wird. Während das Blut zirkuliert, diffundieren Toxine oder Medikamente in die Zellen und werden vom absorbierenden Material zurückgehalten. Die Membranen künstlicher Zellen sind viel dünner als bei der Dialyse, und ihre geringe Größe bedeutet, dass sie eine große Membranoberfläche haben. Dies bedeutet, dass ein Teil der Zelle einen theoretischen Stoffübergang haben kann, der hundertmal höher ist als der einer ganzen künstlichen Nierenmaschine. Das Gerät wurde als klinische Routinemethode für Patienten etabliert, die wegen versehentlicher oder suizidaler Vergiftung behandelt wurden, wurde jedoch auch als Therapie bei Leberversagen und Nierenversagen eingeführt, indem ein Teil der Funktion dieser Organe ausgeführt wurde. Künstliche Zell-Hämoperfusion wurde auch zur Verwendung bei der Immunoadsorption vorgeschlagen, durch die Antikörper aus dem Körper entfernt werden können, indem ein immunadsorbierendes Material wie Albumin auf der Oberfläche der künstlichen Zellen angebracht wird. Dieses Prinzip wurde zur Entfernung von Blutgruppenantikörpern aus Plasma zur Knochenmarktransplantation und zur Behandlung von Hypercholesterinämie durch monoklonale Antikörper zur Entfernung von Lipoproteinen niedriger Dichte verwendet. Hämoperfusion ist besonders in Ländern mit einer schwachen Hämodialyse-Industrie nützlich, da die Geräte dort tendenziell billiger sind und bei Patienten mit Nierenversagen eingesetzt werden.
Eingekapselte Zellen
Die gebräuchlichste Methode zur Herstellung künstlicher Zellen ist die Zellverkapselung. Eingekapselte Zellen werden typischerweise durch die Erzeugung von Tröpfchen mit kontrollierter Größe aus einer flüssigen Zellsuspension erreicht, die dann schnell verfestigt oder geliert werden, um zusätzliche Stabilität bereitzustellen. Die Stabilisierung kann durch Temperaturänderung oder durch Materialvernetzung erreicht werden. Die Mikroumgebung, die eine Zelle sieht, ändert sich bei der Einkapselung. Es geht typischerweise von einer Monoschicht zu einer Suspension in einem Polymergerüst innerhalb einer Polymermembran. Ein Nachteil der Technik besteht darin, dass das Einkapseln einer Zelle ihre Lebensfähigkeit und die Fähigkeit zur Proliferation und Differenzierung verringert. Nach einiger Zeit innerhalb der Mikrokapsel bilden die Zellen Cluster, die den Austausch von Sauerstoff und Stoffwechselabfall hemmen, was zu Apoptose und Nekrose führt, wodurch die Wirksamkeit der Zellen eingeschränkt und das Immunsystem des Wirts aktiviert wird. Künstliche Zellen waren erfolgreich bei der Transplantation einer Anzahl von Zellen, einschließlich Langerhans-Inseln zur Behandlung von Diabetes, Nebenschilddrüsenzellen und Nebennierenrindenzellen.
Eingekapselte Hepatozyten
Der Mangel an Organspendern macht künstliche Zellen zu Schlüsselakteuren bei alternativen Therapien für Leberversagen. Die Verwendung von künstlichen Zellen bei der Hepatozyten-Transplantation hat die Durchführbarkeit und Wirksamkeit der Leberfunktion in Modellen für Lebererkrankungen bei Tieren und bioartifiziellen Lebergeräten gezeigt. Die Forschung ging von Experimenten aus, bei denen die Hepatozyten an der Oberfläche eines Mikroträgers befestigt waren und sich zu Hepatozyten entwickelt haben, die in einer dreidimensionalen Matrix in Alginatmikrotröpfchen eingeschlossen sind, die von einer Außenhaut aus Polylysin bedeckt sind. Ein entscheidender Vorteil dieser Abgabemethode ist die Umgehung der Immunsuppressionstherapie für die Dauer der Behandlung. Hepatozyten-Einkapselungen wurden zur Verwendung in einer bioartifischen Leber vorgeschlagen. Die Vorrichtung besteht aus einer zylindrischen Kammer, in die isolierte Hepatozyten eingebettet sind, durch die das Patientenplasma in einer Art Hämoperfusion extrakorporal zirkuliert wird. Da Mikrokapseln ein großes Verhältnis von Oberfläche zu Volumen aufweisen, bieten sie eine große Oberfläche für die Substratdiffusion und können eine große Anzahl von Hepatozyten aufnehmen. Die Behandlung von Mäusen mit Leberversagen zeigte eine signifikante Erhöhung der Überlebensrate. Künstliche Leber- systeme befinden sich noch in der frühen Entwicklung, zeigen jedoch das Potenzial für Patienten, die auf eine Organtransplantation warten oder während sich die eigene Leber des Patienten ausreichend regeneriert, um die normale Funktion wieder aufzunehmen. Bisher haben klinische Studien mit künstlichen Leber-Systemen und Hepatozyten-Transplantationen bei Lebererkrankungen im Endstadium eine Verbesserung der Gesundheitsmerkmale gezeigt, die Überlebensrate jedoch noch nicht verbessert. Die kurze Lebensdauer und die Aggregation künstlicher Hepatozyten nach der Transplantation sind die größten Hindernisse. Hepatozyten, die gemeinsam mit Stammzellen verkapselt wurden, zeigen eine bessere Lebensfähigkeit in Kultur und nach der Implantation und Implantation von künstlichen Stammzellen allein haben sie auch eine Leberregeneration gezeigt. Als solches ist Interesse an der Verwendung von Stammzellen für die Einkapselung in der regenerativen Medizin entstanden.
Eingekapselte Bakterienzellen
Die orale Aufnahme von lebenden bakteriellen Zellkolonien wurde vorgeschlagen und befindet sich derzeit in der Therapie, unter anderem zur Modulation der Darmflora, zur Vorbeugung von Durchfallerkrankungen, zur Behandlung von H. Pylori-Infektionen, atopischen Entzündungen, Laktoseintoleranz und Immunmodulation. Der vorgeschlagene Wirkmechanismus ist nicht vollständig verstanden, hat jedoch zwei Hauptwirkungen. Der erste ist der ernährungsphysiologische Effekt, bei dem die Bakterien mit toxinproduzierenden Bakterien konkurrieren. Der zweite ist der hygienische Effekt, der die Kolonisationsresistenz anregt und die Immunreaktion anregt. Die orale Abgabe von Bakterienkulturen ist oft ein Problem, da sie vom Immunsystem angegriffen und bei oraler Einnahme häufig zerstört werden. Künstliche Zellen helfen, diese Probleme anzugehen, indem sie eine Nachahmung im Körper und eine selektive oder langfristige Freisetzung ermöglichen, wodurch die Lebensfähigkeit von Bakterien erhöht wird, die das Magen-Darm-System erreichen. Darüber hinaus kann die Verkapselung lebender bakterieller Zellen so gestaltet werden, dass kleine Moleküle, einschließlich Peptide, für therapeutische Zwecke in den Körper diffundieren können. Membranen, die sich für die Bakterienabgabe als erfolgreich erwiesen haben, umfassen Celluloseacetat und Alginatvarianten. Zusätzliche Verwendungen, die sich aus der Einkapselung von Bakterienzellen ergeben haben, umfassen den Schutz gegen das Auftreten von M. Tuberkulose und die Hochregulierung von Ig-sekretierenden Zellen aus dem Immunsystem. Die Technologie ist durch das Risiko systemischer Infektionen, nachteiliger Stoffwechselaktivitäten und das Risiko eines Gentransfers eingeschränkt. Die größere Herausforderung bleibt jedoch die Abgabe ausreichender lebensfähiger Bakterien an die interessierende Stelle.
Künstliche Blutzelle
Sauerstoffträger
Sauerstoffträger in Nanogröße werden als eine Art Ersatz für rote Blutkörperchen verwendet, obwohl ihnen andere Bestandteile der roten Blutkörperchen fehlen. Sie bestehen aus einem synthetischen Polymersom oder einer künstlichen Membran, die gereinigtes tierisches, menschliches oder rekombinantes Hämoglobin umgibt. Insgesamt ist die Hämoglobinabgabe weiterhin eine Herausforderung, da sie ohne Modifikationen hochgiftig ist. In einigen klinischen Studien wurden Vasopressoreffekte für Hämoglobinblutersatz der ersten Generation beobachtet.
rote Blutkörperchen
Forschungsinteresse an der Verwendung künstlicher Zellen für Blut entstand nach der AIDS-Angst der 1980er Jahre. Künstliche Erythrozyten sind nicht nur möglich, um die Übertragung von Krankheiten zu umgehen, sondern auch, weil sie die Nachteile allogener Bluttransfusionen, wie Bluttypisierung, Immunreaktionen und ihre kurze Lagerzeit von 42 Tagen, beseitigen. Ein Hämoglobinersatz kann bei Raumtemperatur gelagert werden und darf nicht länger als ein Jahr gekühlt werden. Es wurde versucht, eine vollständig funktionierende rote Blutzelle zu entwickeln, die nicht nur einen Sauerstoffträger, sondern auch die mit der Zelle assoziierten Enzyme umfasst. Der erste Versuch erfolgte 1957 durch Ersetzen der Erythrozytenmembran durch eine ultradünne Polymermembran, an die sich eine Verkapselung durch eine Lipidmembran und in letzter Zeit eine biologisch abbaubare Polymermembran anschließt. Eine biologische Membran aus roten Blutkörperchen, die Lipide und assoziierte Proteine enthält, kann auch verwendet werden, um Nanopartikel einzukapseln und die Verweildauer in vivo zu erhöhen, indem die Makrophagenaufnahme und die systemische Clearance umgangen werden.
Leuko-Polymersome
Ein Leukopolymerom ist ein Polymerom, das so konstruiert ist, dass es die adhäsiven Eigenschaften eines Leukozyten besitzt. Polymersome sind Vesikel, die aus einer Doppelschicht bestehen, die viele aktive Moleküle wie Medikamente oder Enzyme einkapseln kann. Durch Hinzufügen der Hafteigenschaften eines Leukozyten zu ihren Membranen können sie dazu gebracht werden, sich innerhalb des schnell fließenden Kreislaufsystems an den Epithelwänden abzubremsen oder zu rollen.
Synthetische Zellen
Die minimale Zelle
Der deutsche Pathologe Rudolf Virchow brachte die Idee vor, dass nicht nur Leben aus Zellen entsteht, sondern jede Zelle aus einer anderen Zelle stammt; „Omnis cellula e cellula“. Bisher haben die meisten Versuche, eine künstliche Zelle zu erstellen, nur ein Paket erstellt, das bestimmte Aufgaben der Zelle nachahmen kann. Fortschritte bei zellfreien Transkriptions- und Translationsreaktionen ermöglichen die Expression vieler Gene, aber diese Bemühungen sind weit davon entfernt, eine voll funktionsfähige Zelle zu erzeugen.
Die Zukunft liegt in der Schaffung einer Protozelle oder einer Zelle, die alle Mindestanforderungen für das Leben hat. Mitglieder des J. Craig Venter Institute haben einen computergestützten Top-Down-Ansatz verwendet, um Gene in einem lebenden Organismus auf ein Minimum an Genen zu beschränken. 2010 gelang es dem Team, einen replizierenden Stamm von Mycoplasma mycoides (Mycoplasma laboratorium) zu schaffen, wobei synthetisch erzeugte DNA als Mindestanforderung für das Leben angesehen wurde, die in ein genomisch leeres Bakterium eingefügt wurde. Es ist zu hoffen, dass der Prozess der Top-down-Biosynthese die Einfügung neuer Gene ermöglicht, die gewinnbringende Funktionen erfüllen, beispielsweise die Erzeugung von Wasserstoff als Brennstoff oder die Aufnahme von überschüssigem Kohlendioxid in der Atmosphäre. Die zahlreichen Regulierungs-, Stoffwechsel- und Signalnetzwerke sind nicht vollständig charakterisiert. Diese Top-down-Ansätze haben Einschränkungen für das Verständnis der grundlegenden molekularen Regulation, da die Wirtsorganismen eine komplexe und unvollständig definierte molekulare Zusammensetzung haben.
Ein Bottom-up-Ansatz zum Aufbau einer künstlichen Zelle würde die Schaffung einer Protozelle de novo umfassen, die ausschließlich aus nicht lebenden Materialien besteht. Es wird vorgeschlagen, ein Phospholipid-Doppelschicht-Vesikel mit DNA zu erzeugen, die sich unter Verwendung synthetischer genetischer Informationen selbst reproduzieren kann. Die drei Hauptelemente solcher künstlichen Zellen sind die Bildung einer Lipidmembran, DNA- und RNA-Replikation durch einen Template-Prozess und die Gewinnung chemischer Energie für den aktiven Transport durch die Membran. Die wichtigsten Hürden, die bei dieser vorgeschlagenen Protozelle vorhergesehen und angetroffen wurden, sind die Schaffung einer minimalen synthetischen DNA, die alle für das Leben ausreichenden Informationen enthält, und die Reproduktion nicht-genetischer Komponenten, die für die Zellentwicklung wesentlich sind, wie etwa die molekulare Selbstorganisation. Es wird jedoch gehofft, dass ein solcher Bottom-up-Ansatz Einblick in die grundlegenden Fragen von Organisationen auf zellulärer Ebene und die Ursprünge des biologischen Lebens bietet. Bisher wurde keine vollständig künstliche Zelle, die sich selbst reproduzieren kann, aus den Molekülen des Lebens synthetisiert. Dieses Ziel befindet sich noch in ferner Zukunft, obwohl verschiedene Gruppen derzeit auf dieses Ziel hinarbeiten.
Eine andere vorgeschlagene Methode, um eine Protozelle zu erzeugen, ähnelt den Bedingungen, die während der Evolution als „Ursuppe“ bekannt waren. Verschiedene RNA-Polymere könnten in Vesikeln eingekapselt werden und bei so kleinen Randbedingungen würden chemische Reaktionen getestet.
Große Investitionen in die Biologie wurden von großen Unternehmen wie ExxonMobil getätigt, die mit Synthetic Genomics Inc. eine Partnerschaft eingegangen sind. Craig Venter’s eigenes Biosynthetics-Unternehmen bei der Entwicklung von Treibstoff aus Algen.
Elektronische künstliche Zelle
Das Konzept einer elektronischen künstlichen Zelle wurde in einer Reihe von 3 EU-Projekten erweitert, die von John McCaskill von 2004 bis 2015 koordiniert wurden.
Die Europäische Kommission unterstützte die Entwicklung des Programms „Programmable Artificial Cell Evolution“ (PACE) von 2004-2008, dessen Ziel es war, die Grundlage für die Schaffung „mikroskopischer selbstorganisierender, sich selbst replizierender und evolvierbarer autonomer Einheiten zu schaffen, die aus einfachen Elementen aufgebaut sind Organische und anorganische Substanzen, die genetisch so programmiert werden können, dass sie bestimmte Funktionen erfüllen, um sie in Informationssysteme zu integrieren. Das PACE-Projekt entwickelte die erste Omega-Maschine, ein mikrofluidisches Lebenserhaltungssystem für künstliche Zellen, das chemisch fehlende Funktionen ergänzen könnte (wie ursprünglich von Norman Packard, Steen Rasmussen, Mark Beadau und John McCaskill vorgeschlagen). Das ultimative Ziel bestand darin, eine evolvierbare Hybridzelle in einer komplexen programmierbaren Umgebung im Mikromaßstab zu erreichen. Die Funktionen der Omega-Maschine könnten dann schrittweise entfernt werden, was eine Reihe lösbarer evolutionärer Herausforderungen für die künstliche Zellchemie darstellt. Das Projekt erreichte eine chemische Integration von bis zu drei Paaren der drei Kernfunktionen künstlicher Zellen (eines genetischen Subsystems, eines Containmentsystems und eines Stoffwechselsystems) und generierte neuartige räumlich aufgelöste programmierbare mikrofluidische Umgebungen für die Integration von Containment und genetischer Amplifikation. „Programmable Artificial Cell Evolution“ (PACE) Das Projekt führte zur Schaffung eines Europäischen Zentrums für lebende Technologie], das nun ähnliche Forschungsarbeiten fortsetzt.
Im Anschluss an diese Forschung schlug John McCaskill 2007 vor, sich auf eine elektronisch ergänzte künstliche Zelle zu konzentrieren, die als elektronische chemische Zelle bezeichnet wird. Die Schlüsselidee bestand darin, eine massiv parallele Anordnung von Elektroden zu verwenden, die an lokal dedizierte elektronische Schaltungen in einem zweidimensionalen dünnen Film gekoppelt waren, um die aufkommende chemische Zellfunktionalität zu ergänzen. Lokale elektronische Informationen, die die Elektrodenschalt- und Erfassungsschaltungen definieren, könnten als elektronisches Genom dienen und die molekularen sequentiellen Informationen in den entstehenden Protokollen ergänzen. Ein Forschungsvorschlag mit der Europäischen Kommission war erfolgreich, und ein internationales Wissenschaftlerteam, das sich teilweise mit dem PACE-Konsortium überschneidet, begann seine Arbeit 2008-2012 an dem Projekt Electronic Chemical Cells. Das Projekt zeigte unter anderem, dass der elektronisch kontrollierte lokale Transport spezifischer Sequenzen als künstliches räumliches Kontrollsystem für die genetische Proliferation zukünftiger künstlicher Zellen verwendet werden kann und dass Kernprozesse des Metabolismus durch entsprechend beschichtete Elektrodenarrays bereitgestellt werden können.
Abgesehen von den anfänglichen Schwierigkeiten bei der Beherrschung der Elektrochemie im Mikromaßstab und der Elektrokinetik besteht die Haupteinschränkung darin, dass das elektronische System als starres, nicht autonomes Stück makroskopischer Hardware miteinander verbunden ist. 2011 schlug McCaskill vor, die Geometrie der Elektronik und Chemie umzukehren: Anstatt Chemikalien in ein aktives elektronisches Medium zu legen, platzieren Sie mikroskopisch kleine autonome Elektronik in einem chemischen Medium. Er organisierte ein Projekt, um eine dritte Generation elektronischer künstlicher Zellen auf der 100-µm-Skala in Angriff zu nehmen, die sich aus zwei Halbzellen „Labletten“ selbst zusammensetzen konnte, um einen inneren chemischen Raum zu umschließen, und mit Hilfe aktiver elektronischer Medien betrieben wird Sie werden eingetaucht. Solche Zellen können sowohl ihren elektronischen als auch ihren chemischen Inhalt kopieren und können sich innerhalb der durch ihre speziellen vorsynthetisierten mikroskopischen Bausteine gebotenen Beschränkungen weiterentwickeln. Im September 2012 begann die Arbeit an diesem Projekt Microscale Chemically Reactive Electronic Agents.
Ethik und Kontroverse
Die Protocell-Forschung hat zu Kontroversen und widersprüchlichen Meinungen geführt, darunter auch Kritiker der vagen Definition des „künstlichen Lebens“. Die Schaffung einer grundlegenden Einheit des Lebens ist das vordringlichste ethische Problem, obwohl die Sorge um Protozellen am weitesten verbreitet ist, dass sie durch unkontrollierte Replikation die menschliche Gesundheit und die Umwelt gefährdet.