الخلية الاصطناعية أو الخلية الدنيا هي جسيم هندسي يحاكي وظيفة أو عدة وظائف للخلية البيولوجية. لا يشير المصطلح إلى كيان مادي محدد ، بل إلى فكرة أنه يمكن استبدال أو تكميل وظائف أو هياكل معينة من الخلايا البيولوجية بكيان اصطناعي. في كثير من الأحيان ، تكون الخلايا الاصطناعية أغشية بيولوجية أو بوليمرية تحتوي على مواد نشطة بيولوجيًا. على هذا النحو ، تأهلت الجسيمات النانوية ، الجسيمات الشحمية ، البوليميرات ، والكيسات الدقيقة وعدد من الجسيمات الأخرى كخلايا اصطناعية. يسمح التغليف الدقيق بعملية التمثيل الغذائي داخل الغشاء ، وتبادل الجزيئات الصغيرة والوقاية من مرور المواد الكبيرة عبرها. المزايا الرئيسية للتغليف تشمل تقليد محسنة في الجسم ، وزيادة قابلية الذوبان للبضائع وانخفاض الاستجابات المناعية. وتجدر الإشارة إلى أن الخلايا الاصطناعية قد نجحت سريريًا في حدوث فقر الدم (hemoperfusion).
في مجال البيولوجيا التخليقية ، تم تعريف خلية اصطناعية “حية” على أنها خلية صناعية تمامًا يمكنها التقاط الطاقة والحفاظ على التدرجات الأيونية وتحتوي على جزيئات ضخمة وكذلك تخزين المعلومات ولديها القدرة على التحور. هذه الخلية ليست مجدية تقنياً حتى الآن ، ولكن تم إنشاء تباين لخلية اصطناعية تم فيها إدخال جينوم اصطناعي بالكامل لخلايا العائلة المضيفة جينيا. على الرغم من عدم كونه مصطنعًا تمامًا نظرًا لأن المكونات السيتوبلازمية وكذلك الغشاء من الخلية المضيفة محفوظة ، فإن الخلية المهندسة تخضع للتحكم في جينوم اصطناعي وتكون قادرة على التكاثر.
التاريخ
تم تطوير أول خلايا اصطناعية بواسطة توماس تشانغ في جامعة ماكغيل في الستينيات. تكونت هذه الخلايا من أغشية فائقة من النايلون أو كولوديون أو بروتين متشابك ، سمحت خواصه النصف دقيقة بانتشار جزيئات صغيرة داخل وخارج الخلية. كانت هذه الخلايا بحجم ميكرون ، وتحتوي على خلايا وأنزيمات وهيموجلوبين ومواد مغناطيسية وممتزات وبروتينات.
تراوحت الخلايا الإصطناعية اللاحقة من مائة ميكرومتر إلى أبعاد نانومترية ويمكن أن تحمل الكائنات الدقيقة واللقاحات والجينات والعقاقير والهرمونات والببتيدات. أول استخدام سريري للخلايا الاصطناعية كان في الدم من خلال تغليف الفحم المنشط.
في السبعينيات ، تمكن الباحثون من إدخال الإنزيمات والبروتينات والهرمونات إلى ميكروكابسولات قابلة للتحلل البيولوجي ، مما أدى لاحقًا إلى الاستخدام السريري لأمراض مثل متلازمة ليز – نيهان. على الرغم من أن أبحاث تشانغ الأولية ركزت على خلايا الدم الحمراء الاصطناعية ، إلا أنه في منتصف التسعينات فقط كانت خلايا الدم الحمراء الاصطناعية قابلة للتحلل. تم استخدام الخلايا الاصطناعية في تغليف الخلايا البيولوجية لأول مرة في العيادة في عام 1994 للعلاج في مريض السكري ومنذ ذلك الحين تم تغليف أنواع أخرى من الخلايا مثل الخلايا الكبدية والخلايا الجذعية البالغة والخلايا المعدلة وراثيا وهي قيد الدراسة لاستخدامها في تجديد الأنسجة. .
في 29 ديسمبر 2011 ، أعلن الكيميائيون في جامعة هارفارد عن إنشاء غشاء خلوي مصطنع.
بحلول عام 2014 ، تم إنتاج خلايا بكتيرية اصطناعية مكررة ذاتيًا بها جدران خلوية و DNA صناعي. في يناير من ذلك العام أنتج الباحثون خلية حقيقية حقيقية النواة قادرة على القيام بتفاعلات كيميائية متعددة من خلال العضيات العاملة.
في سبتمبر 2018 ، طور باحثون في جامعة كاليفورنيا خلايا اصطناعية يمكن أن تقتل البكتيريا. تم تصميم الخلايا من كتل ليبو – مثل كتل ليغو – لتدمير البكتيريا.
المواد
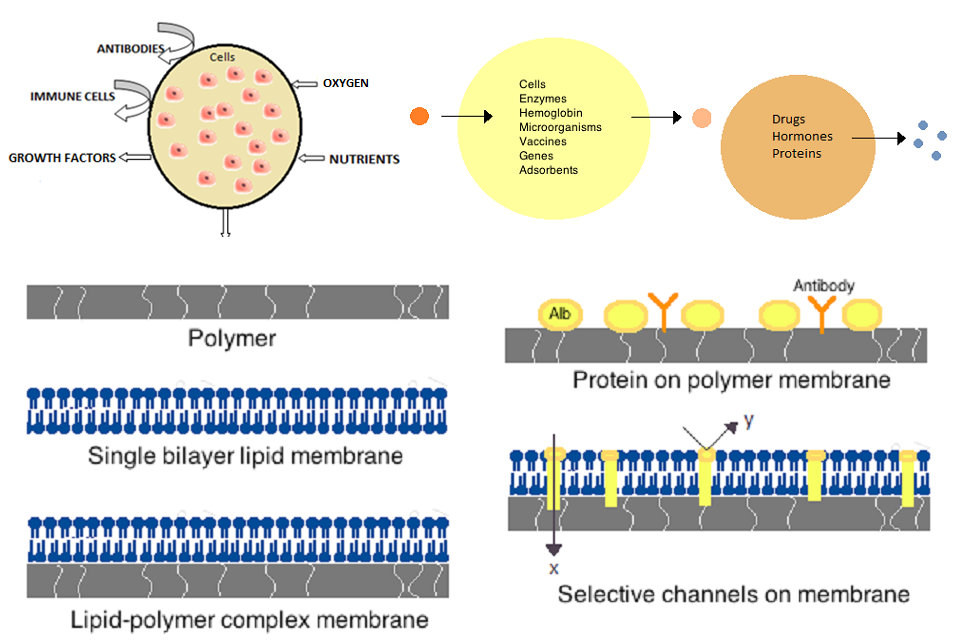
تصنع الأغشية للخلايا الاصطناعية من بوليمرات بسيطة ، أو بروتينات متشابكة ، أو أغشية دهنية ، أو مركبات شحمية بوليمرية. علاوة على ذلك ، يمكن هندسة الأغشية لتقديم بروتينات سطحية مثل الألبومين أو المستضدات أو ناقلات Na / K-ATPase أو المسام مثل القنوات الأيونية. تشمل المواد المستخدمة بشكل شائع لإنتاج الأغشية بوليمرات هيدروجيل مثل الجينات ، السليولوز والبوليمرات الحرارية مثل الهيدروكسي ميثيل ميثاكريلات – ميثيل ميثاكريلات (HEMA-MMA) ، بولي أكريلونيتريل – بولى فينيل كلوريد (PAN-PVC) ، وكذلك اختلافات ما سبق- المذكورة. تحدد المواد المستخدمة نفاذية غشاء الخلية ، والتي تعتمد على البوليمر على الوزن الجزيئي (MWCO). MWCO هو الوزن الجزيئي الأقصى لجزيء يمكن أن يمر بحرية خلال المسام وهو مهم في تحديد الانتشار المناسب للعناصر المغذية والنفايات والجزيئات الهامة الأخرى. تمتلك البوليمرات المائية القدرة على أن تكون متوافقة بيولوجيًا ويمكن تصنيعها في مجموعة متنوعة من الأشكال التي تشتمل على مشابك بوليميرية وخلائط سول-جل ومزائج فيزيائية وجسيمات متشابكة وجسيمات نانوية. من المثير للاهتمام بشكل خاص البوليمرات المستجيبة للمحفزات التي تستجيب لدرجة الحموضة أو التغيرات في درجة الحرارة للاستخدام في التسليم المستهدف. يمكن أن تدار هذه البوليمرات في شكل سائل من خلال حقن الماكروسكوبية وتصلب أو هلام في الموقع بسبب الفرق في درجة الحموضة أو درجة الحرارة. كما تستخدم مستحضرات الجسيمات النانوية والليبوزوم بشكل روتيني لتغليف المواد وتسليمها. الميزة الرئيسية لليبوزومات هي قدرتها على الاندماج في الخلية والأغشية العضية.
تجهيز
وقد تم تطوير العديد من الاختلافات لإعداد الخلايا الاصطناعية والتغليف. عادة ، يتم توليف الحويصلات مثل جسيمات متناهية الصغر ، polymersome أو الحويصلية. يتم تصنيع المستحلب بشكل نموذجي من خلال استخدام معدات الضغط العالي مثل جهاز خلط عالي الضغط أو جهاز ميكروفلويزر. كما تم وصف طريقتين للتغليف الصغري للنيتروسليلوز أدناه.
التجانس عالي الضغط
في المجانسة ذات الضغط العالي ، يتم إجبار اثنين من السوائل في تعليق الزيت / السائل من خلال فتحة صغيرة تحت ضغط مرتفع للغاية. تقسم هذه العملية المنتجات وتسمح بإنشاء جسيمات دقيقة للغاية ، صغيرة مثل 1 نانومتر.
Microfluidization
تستخدم هذه التقنية جهاز ميكروفلويزر مبتكر للحصول على كمية أكبر من المعلقات المتجانسة التي يمكن أن تنتج جسيمات أصغر من المجانسة. يستخدم جهاز المجانسة لأول مرة لإنشاء تعليق خشن يتم ضخه بعد ذلك في ميكروفلويزر تحت ضغط مرتفع. ثم ينقسم التدفق إلى تيارين يتفاعلان بسرعات عالية جدًا في غرفة التفاعل حتى يتم الحصول على حجم الجسيمات المطلوب. تسمح هذه التقنية بإنتاج كميات كبيرة من الجسيمات الشحمية الفسفورية وغراء المواد النانوية المادية اللاحقة.
طريقة إسقاط
في هذه الطريقة ، يتم دمج محلول الخلية في اتجاه قطري في محلول كولوديون من نترات السليولوز. بما أن القطرة تنتقل خلال الكولوديون ، فهي مغلفة بغشاء بفضل خصائص البلمرة بين الكولوديون. تستقر الخلية في وقت لاحق في البرافين حيث يضع الغشاء وأخيرًا يعلق محلول ملحي. تُستخدم طريقة الإسقاط لإنشاء خلايا اصطناعية كبيرة تغلف الخلايا البيولوجية والخلايا الجذعية والخلايا الجذعية المهندسة جينيا.
طريقة مستحلب
تختلف طريقة المستحلب في أن المادة المراد تغليفها عادة ما تكون أصغر وتوضع في قاع غرفة تفاعل حيث يضاف الكولوديون إلى الأعلى ويتم طردها بالطرد المركزي ، أو خلاف ذلك من أجل إنشاء مستحلب. ثم يتم تفريق المواد المغلفة وتعليقها في محلول ملحي.
أهمية سريرية
الافراج عن المخدرات والتسليم
تختلف الخلايا الاصطناعية المستخدمة في توصيل الدواء عن غيرها من الخلايا الاصطناعية حيث أن محتوياتها تهدف إلى الانتشار خارج الغشاء ، أو غمرها وهضمها بواسطة خلية مستهدفة مضيف. غالبًا ما يتم استخدام الخلايا الغشائية الشحمية الغشائية ، والتي قد يشار إليها باسم nanocapsules ، أو الجسيمات النانوية ، أو polymersomes ، أو أشكال أخرى من المصطلح.
العلاج الانزيمي
يجري دراسة العلاج الأنزيمي بشكل فعال لأمراض الأيض الجينية حيث يكون الإنزيم معبرًا بشكل مفرط أو غير واضح أو معيب أو غير موجود على الإطلاق. في حالة نقص التعبير أو التعبير عن إنزيم معيب ، يتم إدخال شكل نشط من الإنزيم في الجسم للتعويض عن العجز. من ناحية أخرى ، يمكن التغلب على الإفراط في التعبير الإنزيمي عن طريق إدخال إنزيم غير وظيفي منافس ؛ وهو إنزيم يعمل على تأييض الركيزة إلى منتجات غير نشطة. عندما توضع الإنزيمات داخل خلية اصطناعية ، فإنها يمكن أن تؤدي وظيفتها لفترة أطول بكثير مقارنة بالإنزيمات الحرة ويمكن تحسينها عن طريق اقتران البوليمر.
كان الإنزيم الأول الذي تمت دراسته تحت تغليف الخلايا الاصطناعية هو الأسباراجيناز لعلاج الليمفوساركوما في الفئران. هذا العلاج يؤخر ظهور ونمو الورم. هذه النتائج الأولية أدت إلى مزيد من البحث في استخدام الخلايا الاصطناعية لتوصيل الإنزيم في الأورام الميلانينية التي تعتمد على التيروزين. هذه الأورام لديها اعتماد أعلى على التيروزين من الخلايا الطبيعية للنمو ، وقد أظهرت الأبحاث أن خفض المستويات النظامية للتيروزين في الفئران يمكن أن تمنع نمو الورم الميلانيني. استخدام الخلايا الاصطناعية في تقديم التيروزينات. والإنزيم الذي يساعد على هضم التيروزين ، يسمح باستقرار أفضل للإنزيم ويظهر فعال في إزالة التيروزين دون الآثار الجانبية الشديدة المرتبطة بفساد التيروزين في النظام الغذائي.
العلاج الانزيمي للخلايا الاصطناعية هو أيضا موضع اهتمام لتفعيل الأدوية الأولية مثل ifosfamide في بعض أنواع السرطان. يمكن أن تكون مصممة الخلايا الاصطناعية تغليف الانزيم p450 السيتوكروم الذي يحول هذا الدواء الأولي إلى المخدرات النشطة لتتراكم في سرطان البنكرياس أو زرع الخلايا الاصطناعية بالقرب من موقع الورم. هنا ، سيكون التركيز المحلي لإفوسفاميد مفعل أعلى بكثير من بقية الجسم وبالتالي منع السمية النظامية. كان العلاج ناجحا في الحيوانات وأظهر مضاعفة في متوسطات النجاة بين المرضى الذين يعانون من سرطان البنكرياس المتقدم في المرحلة الأولى من التجارب السريرية ، وثلاث مرات في معدل البقاء على قيد الحياة لمدة عام واحد.
العلاج الجيني
في علاج الأمراض الوراثية ، يهدف العلاج الجيني إلى إدخال أو تغيير أو إزالة الجينات داخل خلايا الفرد المصابة. تعتمد هذه التقنية بشكل كبير على ناقلات الفيروسات التي تثير المخاوف حول الطفرات الموضعية والاستجابة المناعية النظامية التي أدت إلى وفيات الإنسان وتطور اللوكيميا في التجارب السريرية. إن التغلب على الحاجة إلى الناقلات باستخدام الحمض النووي المجرد أو البلازميدي كنظام توصيل خاص بها يواجه أيضًا مشكلات مثل كفاءة تنبيغ منخفضة وضعف استهداف الأنسجة عند إعطاءها بشكل منتظم.
وقد اقترحت الخلايا الاصطناعية باعتبارها ناقل غير الفيروسي الذي يتم تغليف الخلايا غير الذاتية المعدلة وراثيا وغرسها لتوصيل البروتينات المؤتلف في الجسم الحي. وقد ثبت أن هذا النوع من العزل المناعي فعال في الفئران من خلال تقديم خلايا اصطناعية تحتوي على هرمون نمو الفأر الذي أنقذ تأخر النمو في الفئران الطافرة. تقدمت بعض الاستراتيجيات إلى التجارب السريرية البشرية لعلاج سرطان البنكرياس والتصلب الجانبي والتحكم في الألم.
Hemoperfusion
أول استخدام سريري للخلايا الاصطناعية كان في الدم من خلال تغليف الفحم المنشط. الفحم المنشط لديه القدرة على كثف العديد من الجزيئات الكبيرة وقد عرف لفترة طويلة لقدرته على إزالة المواد السامة من الدم في التسمم العرضي أو الجرعة الزائدة. ومع ذلك ، فإن التروية من خلال الإدارة المباشرة للفحم تكون سامة لأنها تؤدي إلى ضمادات وتلف خلايا الدم يتبعها إزالة الصفيحات الدموية. تسمح الخلايا الاصطناعية للسموم بالانتشار في الخلية مع الحفاظ على البضائع الخطرة داخل غشاءها الفائق.
وقد اقترح hemoperfusion الخلايا الاصطناعية كخيار إزالة السموم أقل تكلفة وأكثر كفاءة من غسيل الكلى ، والتي تتم تصفية الدم فقط من خلال فصل الحجم عن طريق الغشاء الفيزيائي. في الدم ، يتم الاحتفاظ بالآلاف من الخلايا الاصطناعية الممتزة داخل حاوية صغيرة من خلال استخدام شاشتين على أي من طرفيها يرشح دم المريض. مع دوران الدم ، تنتشر السموم أو العقاقير في الخلايا وتحتفظ بها المادة الممتصة. أغشية الخلايا الإصطناعية هي أرق بكثير تلك المستخدمة في غسيل الكلى وحجمها الصغير يعني أن لديها مساحة سطح غشاء عالي. وهذا يعني أن جزءاً من الخلية يمكن أن يكون له نقل كتلة نظري أعلى مئة ضعف من جهاز الكلي الاصطناعي بالكامل. وقد تم إنشاء الجهاز كطريقة روتينية سريرية للمرضى المعالجين للتسمم العرضي أو الانتحار ولكن تم تقديمه أيضًا كعلاج في فشل الكبد والفشل الكلوي عن طريق تنفيذ جزء من وظيفة هذه الأعضاء. وقد اقترح أيضا hemoperfusion الخلايا الاصطناعية للاستخدام في امتصاص المناعة التي من خلالها يمكن إزالة الأجسام المضادة من الجسم عن طريق ربط مادة immunoadsorbing مثل الزلال على سطح الخلايا الاصطناعية. وقد استخدم هذا المبدأ لإزالة الأجسام المضادة لمجموعة الدم من البلازما لزراعة نخاع العظم ولعلاج فرط كوليسترول الدم من خلال الأجسام المضادة وحيدة النسيلة لإزالة البروتينات الدهنية منخفضة الكثافة. الدموي هو مفيد بشكل خاص في البلدان ذات الصناعة التحويلية الديلزة الضعيفة حيث أن الأجهزة تميل إلى أن تكون أرخص هناك وتستخدم في مرضى الفشل الكلوي.
خلايا مغلفة
الطريقة الأكثر شيوعا لإعداد الخلايا الاصطناعية هي من خلال تغليف الخلية. عادة ما يتم تحقيق الخلايا المغلفة من خلال توليد قطرات ذات حجم خاضع للتحكم من تعليق خلية سائلة والتي يتم بعد ذلك ترسيخها بسرعة أو تغطيتها بالجيلات لتوفير مزيد من الثبات. يمكن تحقيق الاستقرار من خلال تغيير في درجة الحرارة أو عبر ربط المواد. البيئة المكروية التي ترى الخلية التغييرات على التغليف. عادة ما ينتقل من كونه على أحادي الطبقة إلى معلق في سقالة بوليمر داخل غشاء بوليمري. عيب في هذه التقنية هو أن تغليف الخلية يقلل من قدرتها على البقاء والقدرة على التكاثر والتمييز. علاوة على ذلك ، بعد مرور بعض الوقت داخل الخلية الدقيقة ، تشكل الخلايا العناقيد التي تمنع تبادل الأكسجين والنفايات الأيضية ، مما يؤدي إلى الاستموات والنخر وبالتالي الحد من فعالية الخلايا وتفعيل نظام المناعة الخاص بالمضيف. وقد نجحت الخلايا الصناعية في زرع عدد من الخلايا بما في ذلك جزر لانجرهانز لعلاج مرض السكري ، وخلايا جارات الدرق ، وخلايا قشرة الغدة الكظرية.
كبد خلايا مغلفة
إن نقص المتبرعين بالأعضاء يجعل الخلايا الاصطناعية عوامل أساسية في العلاجات البديلة لفشل الكبد. وقد أثبت استخدام الخلايا الاصطناعية لزراعة خلايا الكبد جدواها وفعاليتها في توفير وظائف الكبد في نماذج أمراض الكبد الحيوانية وأجهزة الكبد الحيوية. وقد انبثقت البحوث عن التجارب التي تم فيها ربط خلايا الكبد بسطح حاملات صغيرة وتطورت إلى خلايا كبدية تم تغليفها في مصفوفة ثلاثية الأبعاد في جزئيات ألجينية صغيرة مغطاة بجلد خارجي من polylysine. من المزايا الرئيسية لهذه الطريقة في التسليم هو التحايل على علاج كبت المناعة طوال مدة العلاج. اقترحت تغليف الكبدي للاستخدام في الكبد الحيوي. يتكون الجهاز من غرفة أسطوانية مدمجة مع خلايا كبدية معزولة يتم من خلالها توزيع بلازما المريض بشكل غير مبدئي في نوع من نزف الدم. لأن الكبسولات الصغيرة لها مساحة سطح عالية إلى نسبة حجم ، فإنها توفر سطحًا كبيرًا لنشر الركائز ويمكن أن تستوعب عددًا كبيرًا من خلايا الكبد. أظهر علاج الفئران الفاشلة الكبد زيادة كبيرة في معدل البقاء على قيد الحياة. لا تزال أنظمة الكبد الاصطناعية في مرحلة مبكرة من النمو ولكنها تظهر إمكانية للمرضى الذين ينتظرون زرع الأعضاء أو عندما يجدد الكبد نفسه بشكل كافٍ لاستئناف الوظيفة الطبيعية. وحتى الآن ، أظهرت التجارب السريرية التي تستخدم أنظمة الكبد الاصطناعية وزرع الخلايا الكبدية في أمراض الكبد في نهاية المرحلة تحسنًا في علامات الصحة ولكنها لم تحسن بعد من البقاء. طول العمر القصير وتجميع خلايا الكبد الاصطناعي بعد الزرع هي العقبات الرئيسية التي واجهتها. تظهر الخلايا الكبدية المغلفة بالخلايا الجذعية جدوى أكبر في الثقافة وبعد زرع وزرع الخلايا الجذعية الاصطناعية وحدها أظهرت أيضًا تجديدًا للكبد. كما نشأ هذا الاهتمام في استخدام الخلايا الجذعية للتغليف في الطب التجديدي.
الخلايا البكتيرية المغلفة
وقد اقترح ابتلاع مستعمرات الخلايا البكتيرية عن طريق الفم ، ويجري حاليا العلاج من أجل تعديل البكتيريا المعوية ، والوقاية من أمراض الإسهال ، والعلاج من عدوى الملوية البوابية ، والالتهابات الاستشرائية ، وعدم تحمل اللاكتوز والتشكيل المناعي ، وغيرها. آلية العمل المقترحة ليست مفهومة بالكامل ولكن يعتقد أن لها تأثيران رئيسيان. الأول هو التأثير التغذوي ، حيث تتنافس البكتيريا مع البكتيريا المنتجة للسمنة. والثاني هو التأثير الصحي ، الذي يحفز المقاومة للاستعمار ويحفز الاستجابة المناعية. غالباً ما يكون التوصيل الشفهي للثقافات البكتيرية مشكلة لأنها مستهدفة من قبل الجهاز المناعي وغالباً ما يتم تدميرها عندما تؤخذ عن طريق الفم. تساعد الخلايا الاصطناعية على معالجة هذه المشكلات عن طريق توفير تقليد في الجسم وانتقائية أو طويلة الأجل وبالتالي زيادة قابلية البكتيريا للوصول إلى الجهاز الهضمي. بالإضافة إلى ذلك ، يمكن تصميم تغليف الخلايا البكتيرية الحية للسماح بنشر الجزيئات الصغيرة بما في ذلك الببتيدات في الجسم لأغراض علاجية. الأغشية التي أثبتت نجاحها في الولادة البكتيرية تشمل أسيتات السليولوز ومتغيرات الجينات. تشمل الاستخدامات الإضافية التي تتخللها عملية تغليف الخلايا البكتيرية الحماية ضد التحدي من M. Tuberculosis وزيادة إفراز خلايا Ig المفرزة من الجهاز المناعي. هذه التكنولوجيا محدودة بسبب مخاطر العدوى الجهازية ، والأنشطة الأيضية الضارة وخطر نقل الجينات. ومع ذلك ، يبقى التحدي الأكبر هو توصيل بكتيريا قابلة للبقاء إلى موقع الاهتمام.
خلايا الدم الاصطناعية
ناقلات الأكسجين
تستخدم حاملات الأكسجين بحجم نانو كنوع من بدائل خلايا الدم الحمراء ، على الرغم من أنها تفتقر إلى مكونات أخرى لخلايا الدم الحمراء. وتتكون من بوليميرات صناعية تركيبية أو غشاء اصطناعي يحيط بالحيوان المنقى أو البشري أو المؤتلف الهيموجلوبين. بشكل عام ، لا يزال إيصال خضاب الدم يشكل تحديًا نظرًا لأنه شديد السمية عند تسليمه دون أية تعديلات. في بعض التجارب السريرية ، لوحظت آثار تجلط الأوعية للبدائل الأولى للدم من الهيموجلوبين.
خلايا الدم الحمراء
الاهتمام البحثي في استخدام الخلايا الاصطناعية للدم نشأ بعد ذعر الإيدز في 1980s. وإلى جانب تجاوز إمكانات انتقال المرض ، فإن خلايا الدم الحمراء الاصطناعية تكون مرغوبة لأنها تقضي على العيوب المرتبطة بنقل الدم اللوجيني مثل كتابة الدم ، وردود الفعل المناعية ، وفترة تخزينه القصيرة 42 يومًا. يمكن تخزين بديل الهيموغلوبين في درجة حرارة الغرفة وليس تحت التبريد لأكثر من عام. وقد بذلت محاولات لتطوير خلايا الدم الحمراء العاملة الكاملة التي تضم الكربونيك ليس فقط ناقلة الأكسجين ولكن أيضا الإنزيمات المرتبطة بالخلية. جرت المحاولة الأولى في عام 1957 باستبدال غشاء الخلية الحمراء بغشاء بوليمري شديد الالتواء أعقبه تغليف بغشاء دهني وغشاء بوليمري قابل للتحلل أخيراً. ويمكن استخدام غشاء خلايا الدم الحمراء البيولوجية بما في ذلك الدهون والبروتينات المرتبطة بها لتغليف الجسيمات النانوية وزيادة وقت الإقامة في الجسم الحي عن طريق تجاوز امتصاص البلعم والتخليص الجهازي.
Leuko-polymersome
بوليميرات الليوكوما polymersome عبارة عن بوليميرات دعامات صممت لتكون لها الخصائص اللاصقة للكريات البيض. Polymersomes هي حويصلات تتكون من ورقة ثنائية الطبقة التي يمكن أن تغلف العديد من الجزيئات النشطة مثل الأدوية أو الإنزيمات. من خلال إضافة الخصائص اللاصقة لكرات الدم البيضاء إلى أغشيتها ، يمكن جعلها تبطئ ، أو تتدحرج على طول الجدران الظهارية داخل نظام الدورة الدموية المتدفق بسرعة.
الخلايا الاصطناعية
الخلية الدنيا
طرح عالم الأمراض الألماني رودولف فيرشو فكرة أن الحياة لا تنشأ من الخلايا فحسب ، بل تأتي كل خلية من خلية أخرى. “Omnis cellula e cellula”. حتى الآن ، قامت معظم محاولات إنشاء خلية اصطناعية فقط بإنشاء حزمة يمكنها تقليد مهام معينة في الخلية. إن التقدم في تفاعلات النسخ والترجمة الخالية من الخلايا يسمح بالتعبير عن العديد من الجينات ، ولكن هذه الجهود بعيدة كل البعد عن إنتاج خلية تعمل بشكل كامل.
المستقبل هو في إنشاء protocell ، أو الخلية التي لديها كل متطلبات الدنيا للحياة. وقد استخدم أعضاء من معهد J. Craig Venter طريقة حسابية من أعلى إلى أسفل لضرب الجينات في كائن حي إلى مجموعة أدنى من الجينات. في عام 2010 ، نجح الفريق في إنشاء سلالة مكررة من myycides (myycides) (Mycoplasma laboratorium) باستخدام الحمض النووي المنشأ بشكل صناعي والذي يعتبر الحد الأدنى المطلوب للحياة والذي تم إدخاله في البكتيريا الفارغة جينيا. ومن المأمول أن تمكن عملية التخليق الحيوي من الأعلى إلى الأسفل من إدخال جينات جديدة تؤدي وظائف مربحة مثل توليد الهيدروجين للوقود أو التقاط ثاني أكسيد الكربون الزائد في الغلاف الجوي. لا يتم تمييز الشبكات التنظيمية والأيضية والتشويرية بشكل كامل. هذه الأساليب من أعلى إلى أسفل لها حدود لفهم التنظيم الجزيئي الأساسي ، حيث أن الكائنات المضيفة لها تركيبة جزيئية معقدة غير محددة.
ومن شأن اتباع نهج من أسفل إلى أعلى لبناء خلية اصطناعية أن ينطوي على إنشاء خلية جديدة من المواد غير الحية. يقترح إنشاء حويصلة ثنائية الطبقة phospholipid مع DNA قادرة على إعادة توليد الذات باستخدام المعلومات الوراثية الاصطناعية. العناصر الأساسية الثلاثة لهذه الخلايا الاصطناعية هي تشكيل الغشاء الدهني ، وتكرار الحمض النووي RNA من خلال عملية القالب وحصاد الطاقة الكيميائية للنقل النشط عبر الغشاء. تتمثل العقبات الرئيسية المتوقعة والمتوقعة في هذا النموذج البروتوسيل المقترح في إنشاء الحد الأدنى من الحمض النووي التركيبي الذي يحمل جميع المعلومات الكافية للحياة ، وتكاثر المكونات غير الوراثية التي تعتبر جزءًا لا يتجزأ من تطور الخلية مثل التنظيم الذاتي الجزيئي. ومع ذلك ، من المأمول أن يوفر هذا النوع من النهج التصاعدي نظرة ثاقبة للمسائل الأساسية للمنظمات على المستوى الخلوي وأصول الحياة البيولوجية. حتى الآن ، لم يتم تصنيع أي خلية اصطناعية قادرة على التكاثر الذاتي باستخدام جزيئات الحياة ، ولا يزال هذا الهدف في المستقبل البعيد على الرغم من أن مجموعات مختلفة تعمل في الوقت الحالي نحو تحقيق هذا الهدف.
وهناك طريقة أخرى مقترحة لتكوين بروتوسيل أكثر شبهاً بالظروف التي يُعتقد أنها كانت موجودة خلال التطور المعروف باسم الحساء البدائي. يمكن تغليف بوليمرات RNA المختلفة في الحويصلات وفي مثل هذه الحالات الحدودية الصغيرة ، سيتم اختبار التفاعلات الكيميائية.
قامت شركات كبيرة مثل “إكسون موبيل” (ExxonMobil) ، التي شاركت في “سينتاكتوم جينوميكس” ، بالاستثمار الثقيل في علم الأحياء. شركة كريغ فنتر للبيولوجيا الحيوية في تطوير الوقود من الطحالب.
خلية اصطناعية الكترونية
تم توسيع مفهوم الخلية الاصطناعية الإلكترونية في سلسلة من 3 مشاريع للاتحاد الأوروبي قام بتنسيقها جون مكاسكيل من 2004-2015.
رعت المفوضية الأوروبية تطوير برنامج “تطور الخلايا الاصطناعية القابلة للبرمجة” (PACE) من 2004-2008 والذي كان هدفه هو وضع الأساس لإنشاء “كيانات ذاتية التنظيم مجهريًا ذاتيًا ، مكررة ذاتيًا وقابلة للتطور ، مبنية من المواد العضوية وغير العضوية التي يمكن برمجتها وراثيا لأداء وظائف محددة “من أجل التكامل في نهاية المطاف في نظم المعلومات. طور مشروع PACE أول جهاز أوميغا ، وهو نظام دعم الحياة الميكروفلويديك للخلايا الاصطناعية التي يمكن أن تكمل الوظائف المفقودة كيميائياً (كما اقترح أصلاً نورمان باكارد وستين راسموسن ومارك بيلداو وجون مكاسكيل). كان الهدف النهائي هو الحصول على خلية هجينة قابلة للتطور في بيئة قابلة للبرمجة المعقدة المعقدة. يمكن بعد ذلك إزالة وظائف آلة أوميغا ، مما يشكل سلسلة من تحديات التطور القابلة للحل لكيمياء الخلايا الاصطناعية. حقق المشروع تكاملاً كيميائياً إلى مستوى أزواج من الوظائف الأساسية الثلاث للخلايا الاصطناعية (نظام فرعي جيني ، ونظام احتواء ونظام استقلابي) ، وولد بيئات ميكروفلويدية مبرمجة قابلة للتكيف مكانياً مكانياً لدمج الاحتواء والتضخيم الوراثي. “تطور الخلية الاصطناعية القابلة للبرمجة” (PACE) أدى المشروع إلى إنشاء المركز الأوروبي لتكنولوجيا المعيشة] الذي يواصل الآن بحثًا مشابهًا.
بعد هذا البحث ، في عام 2007 ، اقترح جون McCaskill التركيز على خلية اصطناعية مكملة إلكترونياً ، تسمى الخلية الكيميائية الإلكترونية. كانت الفكرة الأساسية هي استخدام مجموعة متوازية من الأقطاب الكهربائية إلى جانب الدوائر الإلكترونية الإلكترونية المخصصة ، في فيلم رقيق ثنائي الأبعاد ، لتكملة الوظائف الخلوية الكيميائية الناشئة. يمكن أن تعمل المعلومات الإلكترونية المحلية التي تحدد الدوائر الكهربائية ودارات الاستشعار عن بعد بمثابة جينوم إلكتروني ، يستكمل المعلومات المتسلسلة الجزيئية في البروتوكولات الناشئة. وقد نجح اقتراح بحث مع المفوضية الأوروبية وفريق دولي من العلماء المتداخل جزئياً مع كونسورتيوم PACE بدأ العمل 2008-2012 في مشروع الخلايا الكيميائية الإلكترونية. وأظهر المشروع ، ضمن أشياء أخرى ، أن النقل المحلي الذي يتم التحكم فيه إلكترونيا لتسلسلات محددة يمكن استخدامه كنظام تحكم مكاني اصطناعي للانتشار الوراثي للخلايا الاصطناعية في المستقبل ، وأن العمليات الأساسية للتمثيل الغذائي يمكن توصيلها بواسطة صفائف قطبية مطلية بشكل مناسب.
القيد الرئيسي لهذا النهج ، بصرف النظر عن الصعوبات الأولية في اتقان الكيمياء الكهربائية الميكروسكوبية والكهربائية ، هو أن النظام الإلكتروني مترابطة كقطعة جامدة غير مستقلة من الأجهزة العيانية. في عام 2011 ، اقترح McCaskill عكس هندسة الإلكترونيات والكيمياء: بدلاً من وضع مواد كيميائية في وسط إلكتروني نشط ، لوضع الإلكترونيات الإلكترونية المجهرية في وسط كيميائي. نظم مشروعًا للتصدي لجيل ثالث من الخلايا الاصطناعية الإلكترونية في نطاق 100 ميكرومتر والذي يمكن أن يتجمع ذاتيًا من خليتين من “الخلايا” لإحاطة مساحة كيميائية داخلية ، ويعملان بمساعدة الإلكترونيات النشطة التي تعمل بالطاقة المتوسطة هذه الخلايا يمكن أن تنسخ محتوياتها الإلكترونية والكيميائية وستكون قادرة على التطور ضمن القيود التي توفرها وحدات البناء الخاصة بها المجهرية المسبقة. في سبتمبر 2012 بدأ العمل في هذا المشروع Microscale وكلاء الإلكترونية التفاعلية كيميائيا.
الأخلاق والجدل
خلقت البحوث Protocell الجدل والآراء المعارضة ، بما في ذلك النقاد من تعريف غامض من “الحياة الاصطناعية”. إن إنشاء وحدة أساسية للحياة هو القلق الأخلاقي الأكثر إلحاحًا ، على الرغم من أن القلق الأكثر انتشارًا حول الخلايا الوراثية هو تهديدها المحتمل لصحة الإنسان والبيئة من خلال التكرار غير المنضبط.